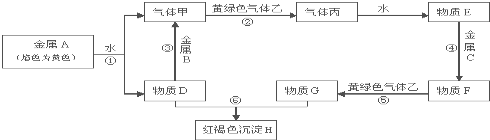
题目内容
18.与50mL0.5mol/L的(NH4)2SO4溶液中,c(NH4+)浓度相同的是( )| A. | 100mL1mol/L的氨水 | B. | 200mL1mol/L的NH4Cl | ||
| C. | 50mL0.5mol/L的CH3COONH4溶液 | D. | 50mL0.5mol/L的NH4NO3 |
分析 50mL0.5mol/L的(NH4)2SO4溶液中,c(NH4+)浓度为0.5mol/L×2=1mol/L,结合溶质的浓度及物质构成计算.
解答 解:A.100mL1mol/L的氨水中c(NH4+)浓度小于1mol/L,故A不选;
B.200mL1mol/L的NH4Cl中,c(NH4+)浓度为1mol/L,故B选;
C.0.5mol/L的CH3COONH4溶液中,c(NH4+)浓度为0.5mol/L,故C不选;
D.0.5mol/L的NH4NO3中,c(NH4+)浓度为0.5mol/L,故D不选;
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握溶质浓度与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,注意离子浓度与溶液的体积无关、不考虑水解等,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
8.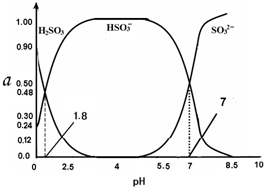 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
9.设NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | NA个氮气分子与3NA个氢气分子恰好生成2NA个氨气分子 | |
| B. | 在1L0.1mol/L的AICI3溶液中含有0.1NA个AI3+ | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 5.6g的铁与足量的稀硝酸反应转移的电子数是0.3NA |
6.对盐的组成叙述正确的是( )
| A. | 都含有原子团 | B. | 都含有金属元素 | ||
| C. | 都不含氢元素 | D. | 都含有非金属元素 |
3.有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,至少需要1mol/L盐酸的体积为( )
| A. | 0.1L | B. | 0.2L | C. | 0.5L | D. | 1.0L |
7.金属M与AgNO3溶液反应的化学方程式为M+2AgNO3=M(NO3)2+2Ag.若M是铜,则下列说法错误的是( )
| A. | M的金属活动性比Ag强 | B. | 反应后溶液的质量增加 | ||
| C. | 金属M不可能变换成铝 | D. | 固体物质的质量增加了 |
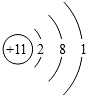 ;A元素电子排布式1s22s22p63s23p4;
;A元素电子排布式1s22s22p63s23p4;