题目内容
5.已知:SO32-+I2+H2O═SO42-+2I-+2H+,某无色溶液中可能含有Na+、NH4+、Cu2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离).下列关于该溶液的判断正确的是( )| A. | 肯定不含I- | B. | 不能确定是否含有SO42- | ||
| C. | 至少含有Na+、NH4+、K+中的两种 | D. | 可能含有Cu2+ |
分析 无色溶液中不存在Cu2+;加入氯水仍然无色,说明氯水发生了反应,且产物无色,I-和SO32-均可与氯水反应使氯水褪色,由于反应后溶液无色,说明没有I2,则原溶液中一定有SO32-;由于SO32-的还原性比I-强,故I-是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,据此进行判断.
解答 解:无色溶液中不存在Cu2+;加入氯水仍然无色,说明氯水发生了反应,且产物无色,I-和SO32-均可与氯水反应使氯水褪色,由于反应后溶液无色,说明没有I2,则原溶液中一定有SO32-;由于SO32-的还原性比I-强,故I-是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,
A.由于SO32-的还原性比I-强,故I-是否存在无法判断,故A错误;
B.因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,故B错误;
C.由于一定存在SO32-,且所有离子浓度相等,根据电荷守恒可知至少含有Na+、NH4+、K+中的两种,故C正确;
D.溶液为无色,则一定不存在有色的铜离子,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子共存的条件,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.向0.1mol•L-1 CH3COOH溶液中加入少量CH3COONa晶体或加水稀释时,都会引起( )
| A. | 溶液的pH增大 | B. | CH3COOH的电离程度增大 | ||
| C. | 溶液的导电能力减小 | D. | 溶液中n(H+)减小 |
13.下列反应不属于氧化还原反应的是( )
| A. | Cl2+H2O=HCl+HClO | B. | Fe+CuSO4=FeSO4+Cu | ||
| C. | 2NaHCO3 $\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2 | D. | Cl2+2FeCl2=3FeCl3 |
3.在5L物质的量浓度为2mol/L的K2SO4溶液中K+的物质的量浓度为( )
| A. | 4mol/L | B. | 5mol/L | C. | 1 mol/L | D. | 20mol/L |
7.下列表示物质形成过程的电子式正确的是( )
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
8.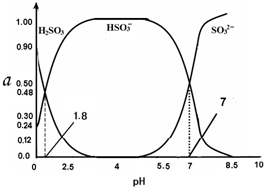 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
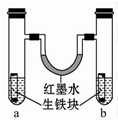 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.