题目内容
下列实验操作或对实验事实的描述不正确的是( )(填序号).
| A、用分液漏斗进行分液操作,将甘油和水的混合物分离 |
| B、从溴的四氯化碳溶液中提取溴,可用苯进行萃取 |
| C、用热的浓HCl洗涤附着有MnO2的试管 |
| D、在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 |
| E、用碱式滴定管量得KMnO4溶液20.50mL |
| F、实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置 |
| G、只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别 |
| H、用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管插入FeSO4溶液中 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.甘油和水互溶;
B.根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
C. 加热条件下,浓盐酸和二氧化锰反应生成可溶性氯化锰;
D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,导致部分硫酸铜分解;
E.高锰酸钾溶液有强氧化性;
F.制备少量H2、O2、NH3、HCl可以用固液不加热装置;
G.加入水后现象不同;
H.Fe(OH)2易被空气中的氧气氧化.
B.根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
C. 加热条件下,浓盐酸和二氧化锰反应生成可溶性氯化锰;
D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,导致部分硫酸铜分解;
E.高锰酸钾溶液有强氧化性;
F.制备少量H2、O2、NH3、HCl可以用固液不加热装置;
G.加入水后现象不同;
H.Fe(OH)2易被空气中的氧气氧化.
解答:
解:A.甘油和水互溶,不能用分液漏斗分离,故A错误;
B.苯和四氯化碳互溶,不能做萃取剂,故B错误;
C.热的浓盐酸和二氧化锰反应生成可溶性氯化锰,稀盐酸和二氧化锰不反应,故C正确;
D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,导致部分硫酸铜分解,固体减少的质量增大,则所测结晶水含量可能会偏高,故D正确.
E.高锰酸钾溶液有强氧化性,只能用酸式滴定管量取,故E错误;
F.实验室快速制备少量H2、O2、NH3、HCl可以用固液不加热装置,故F正确;
G.加入水后,硫酸铜溶液呈蓝色,碳酸钠溶液为无色,碳化钙能与水反应生成气体,故G正确;
H.制备Fe(OH)2操作中的胶头滴管,为了防止空气中氧气氧化氢氧化亚铁,需将胶头滴管下端插入液面以下,故H正确.
故选ABE.
B.苯和四氯化碳互溶,不能做萃取剂,故B错误;
C.热的浓盐酸和二氧化锰反应生成可溶性氯化锰,稀盐酸和二氧化锰不反应,故C正确;
D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,导致部分硫酸铜分解,固体减少的质量增大,则所测结晶水含量可能会偏高,故D正确.
E.高锰酸钾溶液有强氧化性,只能用酸式滴定管量取,故E错误;
F.实验室快速制备少量H2、O2、NH3、HCl可以用固液不加热装置,故F正确;
G.加入水后,硫酸铜溶液呈蓝色,碳酸钠溶液为无色,碳化钙能与水反应生成气体,故G正确;
H.制备Fe(OH)2操作中的胶头滴管,为了防止空气中氧气氧化氢氧化亚铁,需将胶头滴管下端插入液面以下,故H正确.
故选ABE.
点评:本题考查了实验方案评价,涉及知识点较多,明确实验原理是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
扑热息痛是一种优良的解热镇痛剂,其结构式为 ,对此不正确的说法是( )
,对此不正确的说法是( )
 ,对此不正确的说法是( )
,对此不正确的说法是( )| A、该物质水解后不能得到α-氨基酸 |
| B、该物质与苯丙氨酸互为同分异构体 |
| C、该物质能与浓溴水发生取代反应 |
D、该物质可由 和CH3COOH经缩合而成 和CH3COOH经缩合而成 |
23gNa与过量O2反应生成Na2O和Na2O2的混合物,O2得到电子( )
| A、1mol |
| B、2mol |
| C、4mol |
| D、2mol~4mol之间 |
化学与生活密切相关,下列有关做法正确的是( )
| A、为增加明矾净水效果,可同时加入氢氧化钡溶液 |
| B、为了缓解干旱,许多地方使用AgBr人工降雨 |
| C、为防止铁制品生锈,可在铁制品的外层涂油漆 |
| D、计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品 |
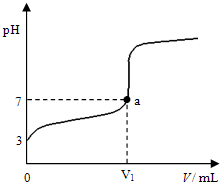 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
1.92g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当Cu全部反应时,共收集到标准状况下气体1.12L,则反应中消耗HNO3的物质的量是( )
| A、0.12 mol |
| B、0.1 mol |
| C、0.11 mol |
| D、0.2 mol |
下列实验方法及操作正确的是( )
| A、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B、使用pH试纸测定未知气体的酸碱性时,不能用蒸馏水润湿试纸 |
| C、将20g KNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应恰好相等 |
