题目内容
下列实验方法及操作正确的是( )
| A、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B、使用pH试纸测定未知气体的酸碱性时,不能用蒸馏水润湿试纸 |
| C、将20g KNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应恰好相等 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.Na2CO3溶液和NaHCO3与氢氧化钙溶液反应都可生成沉淀;
B.测定气体的酸碱性时,pH试纸需要润湿;
C.溶质质量=溶液质量×溶质质量分数=100g×20%=20g;
D.测定中和热时,为使盐酸充分反应,氢氧化钠溶液应过量.
B.测定气体的酸碱性时,pH试纸需要润湿;
C.溶质质量=溶液质量×溶质质量分数=100g×20%=20g;
D.测定中和热时,为使盐酸充分反应,氢氧化钠溶液应过量.
解答:
解:A.碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀,故Ca(OH)2溶液比较是否有沉淀生成的方法不能鉴别二者,故A错误;
B.测定未知气体的酸碱性时,pH试纸需要润湿,故B错误;
C.将20g KNO3完全溶于80 mL水中得到质量分数约为20%的KNO3溶液,故C正确;
D.测定中和热时,为使盐酸充分反应,减少因盐酸挥发而导致实验误差,氢氧化钠溶液应过量,故D错误.
故选C.
B.测定未知气体的酸碱性时,pH试纸需要润湿,故B错误;
C.将20g KNO3完全溶于80 mL水中得到质量分数约为20%的KNO3溶液,故C正确;
D.测定中和热时,为使盐酸充分反应,减少因盐酸挥发而导致实验误差,氢氧化钠溶液应过量,故D错误.
故选C.
点评:本题考查较为综合,涉及物质鉴别、pH试纸使用、溶液配制以及中和热测定等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
下列电离方程式中,不正确的是( )
| A、CH3COOH?CH3COO-+H+ |
| B、Fe2(SO4)3═2Fe2++3SO42- |
| C、Ba(OH)2═Ba2++2OH- |
| D、NaHCO3═Na++HCO3- |
| E、NaHCO3═Na++HCO3- |
下列实验操作或对实验事实的描述不正确的是( )(填序号).
| A、用分液漏斗进行分液操作,将甘油和水的混合物分离 |
| B、从溴的四氯化碳溶液中提取溴,可用苯进行萃取 |
| C、用热的浓HCl洗涤附着有MnO2的试管 |
| D、在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 |
| E、用碱式滴定管量得KMnO4溶液20.50mL |
| F、实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置 |
| G、只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别 |
| H、用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管插入FeSO4溶液中 |
将0.2mol/L的醋酸钠溶液10mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) |
| C、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D、c(CH3COO-)═c(Cl-)═c(CH3COOH)>c(H+) |
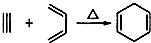 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是