题目内容
23gNa与过量O2反应生成Na2O和Na2O2的混合物,O2得到电子( )
| A、1mol |
| B、2mol |
| C、4mol |
| D、2mol~4mol之间 |
考点:氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:23gNa与过量O2反应生成Na2O和Na2O2,其中钠元素的化合价从0价升高到了+1价,据此确定O2得到电子的量.
解答:
解:23g即1molNa与过量O2反应生成Na2O和Na2O2的混合物,其中钠元素的化合价从0价升高到了+1价,失电子1mol,根据得失电子守恒,O2得到电子的量和金属钠失电子的量相等,所以得电子的量是1mol,故选A.
点评:本题考查学生氧化还原反应中得失电子守恒的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应中,水作为还原剂的是( )
| A、2F2+2H2O═4HF+O2 |
| B、NaOH+HCl═NaCl+H2O |
| C、2Na+2H2O═2Na++2OH-+H2↑ |
| D、Cl2+H2O═HCl+HClO |
将适量的物质分别加到干燥的红色布条上,不能使其褪色的是( )
| A、新制的氯水 |
| B、氯化钙溶液 |
| C、液氯 |
| D、用盐酸酸化的次氯酸钠溶液 |
下列电离方程式中,不正确的是( )
| A、CH3COOH?CH3COO-+H+ |
| B、Fe2(SO4)3═2Fe2++3SO42- |
| C、Ba(OH)2═Ba2++2OH- |
| D、NaHCO3═Na++HCO3- |
| E、NaHCO3═Na++HCO3- |
下列图示与对应的叙述相符的是( )
A、 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 |
B、 表示将1.000 mol?L-1氨水滴入20.00 mL 1.000 mol?L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线 表示将1.000 mol?L-1氨水滴入20.00 mL 1.000 mol?L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线 |
C、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
D、 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液(装置如图1),生成沉淀的量与加入氢氧化钡溶液的体积关系如图2所示,a、b、c、d分别表示实验的不同阶段,下列有关说法中不正确的是( )
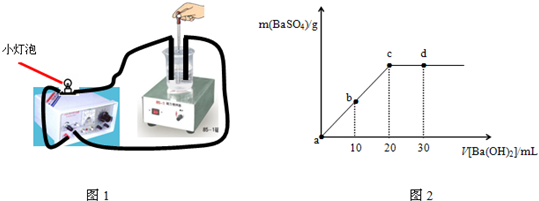

| A、实验过程中小灯泡由亮逐渐变暗直至熄灭,后又逐渐变亮 |
| B、实验中反应发生的条件是有难溶物质和难电离物质生成 |
| C、溶液的pH值:a<b<c<d |
| D、小灯泡的亮度:a>b=d>c |
分子式为C4H10O的醇的同分异构体有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列实验操作或对实验事实的描述不正确的是( )(填序号).
| A、用分液漏斗进行分液操作,将甘油和水的混合物分离 |
| B、从溴的四氯化碳溶液中提取溴,可用苯进行萃取 |
| C、用热的浓HCl洗涤附着有MnO2的试管 |
| D、在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 |
| E、用碱式滴定管量得KMnO4溶液20.50mL |
| F、实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置 |
| G、只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别 |
| H、用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管插入FeSO4溶液中 |