题目内容
4.氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置.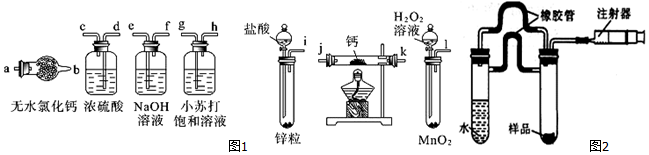
请回答下列问题:
(1)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号).
i→e→f→d→c→j(或k)→k(或j)→a
(2)装有无水氯化钙装置的作用是干燥氢气.
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;BADC(请按正确的顺序填入下列步骤的标号).
A、加热反应一段时间 B、收集气体并检验其纯度
C、关闭分液漏斗活塞 D、停止加热,充分冷却
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤:
①样品称量;
②加入Na2CO3溶液(填化学式),搅拌;
③过滤(填操作名称);洗涤;干燥
④称量碳酸钙.
(5)利用上述题目中给出的装置(试剂可另选)设计实验,用化学方法证明产物中含有氢化钙,写出实验简要步骤及观察到的现象取适量氢化钙,在氧气中燃烧,用无水硫酸铜检验生成物,若固体变蓝,说明是氢化钙.
(6)乙同学利用图2所示装置测定上述实验中得到的氢化钙的纯度.他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定).试通过计算求样品中氢化钙的纯度:91.3%.
分析 氢化钙的制备:锌和稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,氢气中含有水蒸气,通过无水氯化钙进行干燥,在装置中和钙进行反应Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2,生成氢化钙,因氢化钙遇水立即反应生成氢氧化钙和氢气,所以要防止空气中的水蒸气玻璃管中.
(1)一般制备纯净干燥的气体的实验装置的顺序为:制备装置→除杂装置→干燥装置等;
(2)氢气中含有水蒸气,通过无水氯化钙进行干燥;
(3)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸;
(4)从最终称量碳酸钙可知,应加入碳酸盐溶液,使CaH2反应的同时得到碳酸钙沉淀,然后经过滤、洗涤、烘干、称量,确定纯度;
(5)CaH2可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色;
(6)由注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处,可知生成氢气:57.04mL-10mL=47.04mL,所以氢气的质量为:$\frac{0.04704L}{22.4L/mol}$×2g/mol=0.0042g=4.2mg,设混合物中氢化钙的质量为x,生成氢气质量为y,则钙的质量为46mg-x,钙与水反应生成氢气质量为4.2mg-y,根据方程式CaH2+2H2O═Ca(OH)2+2H2↑、Ca+2H2O═Ca(OH)2+H2↑,列方程计算x、y的值,再根据质量分数定义计算.
解答 解:(1)钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氢气中会混有水蒸气和氯化氢,所以在与钙化合之前需要除杂和干燥,分别选用试剂是氢氧化钠和浓硫酸;同时为防止空气中水蒸气进入,最后还需要连接干燥管,所以正确的顺序为:i→e→f→d→c→j(或k)→k(或j)→a;
故答案为:i→e→f→d→c→j(或k)→k(或j)→a;
(2)装有无水氯化钙装置的作用是干燥氢气,故答案为:干燥氢气;
(3)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,故正确的操作顺序为:BADC,
故答案为:BADC;
(4)从最终称量碳酸钙可知,应加入碳酸钠溶液,使CaH2反应的同时得到碳酸钙沉淀,然后经过滤、洗涤、烘干、称量,确定纯度,
故答案为:Na2CO3;过滤;
(5)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色证明为氢化钙,
故答案为:取适量氢化钙,在氧气中燃烧,用无水硫酸铜检验生成物,若固体变蓝,说明是氢化钙;
(6)由注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处,可知生成氢气:57.04mL-10mL=47.04mL,所以氢气的质量为:$\frac{0.04704L}{22.4L/mol}$×2g/mol=0.0042g=4.2mg,设混合物中氢化钙的质量为x,生成氢气质量为y,则钙的质量为46mg-x,钙与水反应生成氢气质量为4.2mg-y,则:
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
所以42:4=x:y,
整理的y=$\frac{2x}{21}$
Ca+2H2O═Ca(OH)2+H2↑
40 2
46mg-x 4.2mg-y
所以40:2=(46mg-x):(4.2mg-y),
将y=$\frac{2x}{21}$代入,解得x=42mg,
所以样品中氢化钙的纯度为:$\frac{42mg}{46mg}$×100%=91.30%,
故答案为:91.3%.
点评 本题以氢化钙制备为载体,考查实验基本技能与操作、对题中的信息的利用、对实验装置的理解分析、物质分离提纯、化学计算、实验方案设计等,是对学生综合能力的考查,题目难度中等.

| A. | 用100 mL量筒量取12.5 mL盐酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 需用220 mL 1 mol•L-1 CuSO4溶液,配制时需称62.5g 的CuSO4•5H2O 晶体 | |
| D. | 所配得的500 mL 0.5mol•L-1 Na2CO3溶液中,Na+的物质的量浓度为0.5mol•L-1 |
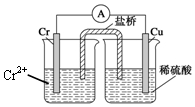 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )| A. | 盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液 | |
| B. | 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 | |
| C. | 此过程中H+得电子,发生氧化反应 | |
| D. | 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中 |
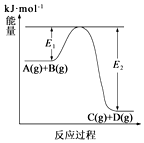
| A. | 上述反应为吸热反应 | B. | 上述反应的△H=E1kJ•mol-1 | ||
| C. | A(g)的能量一定大于C(g) | D. | 反应物的总焓大于反应产物的总焓 |
| A. | Al2O3(SiO2):NaOH溶液 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液 | D. | FeCl2溶液(FeCl3):Fe粉 |
| A. |  配制0.10mol/L NaOH溶液 | |
| B. |  除去CO中的CO2 | |
| C. |  苯萃取碘水中的I2分出水层后的操作 | |
| D. |  除去粗盐溶液中的不溶物 |
| A. |  测定中和热 | B. |  电解食盐水 | ||
| C. |  温度对化学平衡的影响 | D. |  催化剂对反应速率的影响 |