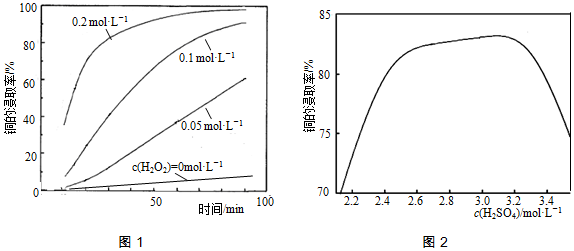
题目内容
14.某同学在实验报告中记录下列数据,其中正确的是( )| A. | 用100 mL量筒量取12.5 mL盐酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 需用220 mL 1 mol•L-1 CuSO4溶液,配制时需称62.5g 的CuSO4•5H2O 晶体 | |
| D. | 所配得的500 mL 0.5mol•L-1 Na2CO3溶液中,Na+的物质的量浓度为0.5mol•L-1 |
分析 A.量筒的感量为0.1mL,且量筒规格应与液体的体积接近;
B.托盘天平的感量为0.1g;
C.需用220 mL 1 mol•L-1 CuSO4溶液,选择250mL容量瓶,结合m=cVM计算;
D.0.5mol•L-1 Na2CO3溶液,结合离子个数计算离子浓度.
解答 解:A.量筒的感量为0.1mL,可选20mL量筒量取12.5 mL盐酸,故A错误;
B.托盘天平的感量为0.1g,则用托盘天平称量5.8g或5.9g食盐,故B错误;
C.需用220 mL 1 mol•L-1 CuSO4溶液,选择250mL容量瓶,CuSO4•5H2O 晶体的质量为0.25L×1mol/L×250g/mol=6.25g,故C正确;
D.0.5mol•L-1 Na2CO3溶液,Na+的物质的量浓度为0.5mol•L-1×2=1mol/L,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
4.已知下列物质在20℃下的Ksp如下,试回答下列问题:
(1)20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
2.03年初春,“SARS病毒”在我国一些地区肆虐,它有极强的传染性,给我国的正常生活和经济建设带来很大的影响,全国人民万众一心,众志诚城,科学防控,在预防过程中,有一种消毒液(H2O2),据此材料,对过氧化氢的性质做出判断.从H2O2的分子组成及结构上分析,其( )
| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
9.恒温时,在体积为V的密闭容器内,可逆反应:N2+3H2?2NH3 达平衡时,测得容器内气体的压强为p1.将容器的体积压缩 $\frac{V}{2}$至达到新的平衡时,气体的压强为 p2.则 p1 和 p2 的关系为( )
| A. | p2<p1 | B. | p1<p2<2p 1 | C. | p1>2p2 | D. | 2p1=p2 |
19.某KNO3溶液中含杂质KCl和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
6.下列事实不能用有机物分子内基团间的相互影响解释的是( )
| A. | 甲苯能使酸性KMnO4溶液褪色,而苯和甲烷不能 | |
| B. | 苯酚能跟NaOH溶液反应而乙醇不能 | |
| C. | 乙烯能发生加成反应而乙烷不能 | |
| D. | 苯在50-60℃时发生硝化反应生成硝基苯,而甲苯在30℃时即可发生硝化反应生成三硝基甲苯 |
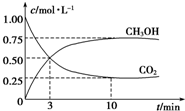 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题: