题目内容
酸雨的形成主要是由于( )
| A、森林遭到乱砍乱伐,破坏了生态环境 |
| B、汽车排出大量尾气 |
| C、大气中二氧化碳的含量增大 |
| D、含硫化石燃料的大量燃烧 |
考点:二氧化硫的污染及治理
专题:元素及其化合物
分析:正常雨水的pH约为5.6,酸雨是指溶液pH小于5.6的雨水;酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成,以此解答该题.
解答:
解:A.森林遭到乱砍滥伐,破坏了生态平衡,不是酸雨的主要原因,故A错误;
B.汽车排出大量尾气,可形成酸雨,但不是主要原因,故B错误;
C.大气中二氧化碳的含量增多,会造成温室效应,故C错误;
D.工业上大量燃烧含硫燃料,是形成酸雨的主要原因,故D正确.
故选D.
B.汽车排出大量尾气,可形成酸雨,但不是主要原因,故B错误;
C.大气中二氧化碳的含量增多,会造成温室效应,故C错误;
D.工业上大量燃烧含硫燃料,是形成酸雨的主要原因,故D正确.
故选D.
点评:本题考查环境污染知识,为高频考点,侧重于化学与环境的考查,有利于培养学生良好的科学素养,提高环境保护意识,难度不大.

练习册系列答案
相关题目
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下:
则下列结论中不正确的是( )
| 100mL盐酸 | 100mL盐酸 | 100mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、盐酸物质的量浓度为1.5mol/L |
| B、15.7g混合物与盐酸反应后有剩余 |
| C、加入9.2 g混合物时消耗HCl 0.1mol |
| D、混合物中NaHCO3和KHCO3的质量比为1:1 |
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
| A、c1:c2=1:3 |
| B、N2、H2的转化率不相等 |
| C、平衡时,H2和NH3的生成速率之比为3:2 |
| D、c1的取值范围为0<c1<0.14 mol/L |
下列溶液中离子浓度的关系一定正确的是( )
| A、等物质的量的弱酸HA与其钾盐KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(A-)>c(H+)=c(OH-) |
化学与生产生活、环境密切相关,下列说法不正确的是( )
| A、亚硝酸钠是一种食品防腐剂,但使用时其用量需要加以限制 |
| B、玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 |
| C、Na2S可除去废水中Hg2+、Pb2+等重金属离子 |
| D、弱酸性或中性条件下,钢铁腐蚀的正极反应式为:4OH--4e-═O2+2H2O |
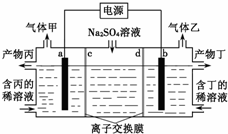 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)| A、a电极反应式为:2H++2e-═H2↑ |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阴离子交换膜 |
| D、每转移0.1 mol电子,产生1.12 L的气体乙 |