题目内容
可逆反应aA(g)+bB(g)?cC(g),改变温度(其他条件不变)、压强(其他条件不变)对上述反应正、逆反应速率的影响分别如图所示,以下叙述正确的是( )


| A、b>c,正反应为放热反应 |
| B、b<c,正反应为吸热反应 |
| C、a+b>c,正反应为放热反应 |
| D、a+b<c,正反应为吸热反应 |
考点:化学反应速率变化曲线及其应用,化学平衡的影响因素
专题:化学平衡专题
分析:由图象可知,升高温度,逆反应速率大于正反应速率,则升高温度,平衡逆向移动;
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,以此来解答.
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,以此来解答.
解答:
解:由图象可知,升高温度,逆反应速率大于正反应速率,则升高温度,平衡逆向移动,所以该正反应为放热反应;
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,该反应为气体气体缩小的反应,所以a+b>c,
故选C.
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,该反应为气体气体缩小的反应,所以a+b>c,
故选C.
点评:本题考查反应速率、化学平衡图象,明确交点为平衡点,利用温度、压强对反应速率的影响分析平衡的移动是解答本题的关键,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
已知热化学方程式:
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列关于各实验装置图的叙述中正确的是( )
A、 除去Cl2中含有的少量HCl |
B、 构成锌-铜原电池 |
C、 结合秒表测量锌与稀硫酸的反应速率 |
D、 验证溴乙烷发生消去反应生成烯烃 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、 氨气发生装置 |
B、 氨气吸收装置 |
C、 氨气发生装置 |
D、 氨气收集、检验装置 |
下述实验能达到预期目的是( )
| 实验内容 | 实验目的 | |
| ① | 分别测定0.01mol/L的HCl和H2S的c(H+) | 比较氯和硫的非金属性强弱 |
| ② | 混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | 除去CO2中少量的SO2 |
| ③ | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| ④ | 将硫酸铜晶体分别放入浓硫酸和稀硫酸中 | 鉴别浓硫酸和稀硫酸 |
| A、②④ | B、①③ | C、①② | D、①④ |
下列各组物质,两者互为同分异构体的是( )
| A、NH4CNO和CO(NH2)2 |
| B、CuSO4?3H2O和CuSO4?5H2O |
C、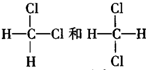 |
| D、H2O和D2O(重水) |
NH3、H2O等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子.根据上述事实可推出ABn型分子是非极性分子的经验规律是( )
| A、在ABn分子中A原子的所有价电子都参与成键 |
| B、在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C、在ABn分子中每个共价键的键长都相等 |
| D、分子中不能含有H原子 |
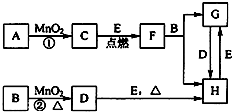 如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.
如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.