题目内容
下列关于各实验装置图的叙述中正确的是( )
A、 除去Cl2中含有的少量HCl |
B、 构成锌-铜原电池 |
C、 结合秒表测量锌与稀硫酸的反应速率 |
D、 验证溴乙烷发生消去反应生成烯烃 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.氯气、HCl均与NaOH溶液反应;
B.锌与硫酸铜直接发生化学反应;
C.气体的体积可由注射器量出;
D.乙醇能使酸性高锰酸钾褪色.
B.锌与硫酸铜直接发生化学反应;
C.气体的体积可由注射器量出;
D.乙醇能使酸性高锰酸钾褪色.
解答:
解:A.因氯气、HCl均与NaOH溶液反应,不能达到除杂的目的,应选用饱和食盐水,故A错误;
B.锌与硫酸铜直接发生化学反应,不形成原电池,故B错误;
C.气体的体积可由注射器量出,结合时间可求出反应速率,故C正确;
D.乙醇易挥发,乙醇能使酸性高锰酸钾褪色,故D错误.
故选C.
B.锌与硫酸铜直接发生化学反应,不形成原电池,故B错误;
C.气体的体积可由注射器量出,结合时间可求出反应速率,故C正确;
D.乙醇易挥发,乙醇能使酸性高锰酸钾褪色,故D错误.
故选C.
点评:本题考查较为综合,涉及除杂、原电池、化学反应速率、物质的性质等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的原理和实验操作的严密性和可行性的评价,难度中等.

练习册系列答案
相关题目
从下列各项可以判断某一元酸是强酸的是( )
| A、该酸可以把CaCO3溶解 |
| B、0.1 mol?L-1该酸溶液中c(OH-)为1×10-12 mol?L-1 |
| C、加热该酸至沸腾也不分解 |
| D、0.1 mol?L-1该酸的pH为1 |
 如图进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8mL O2.下面有关实验最终状态的描述正确的是( )
如图进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8mL O2.下面有关实验最终状态的描述正确的是( )| A、试管内气体呈棕红色 |
| B、试管内气体为无色的NO |
| C、试管内气体为无色的O2 |
| D、试管内液面高度上升到试管底部 |
已知298K时,N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,在相同条件下向密闭容器中加入1molN2和3molH2,达到平衡时的反应热为△H1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2、0.1molNH3,达到平衡时的反应热为△H2,则下列关系正确的是( )
| A、△H1=△H2=-92.4 kJ/mol |
| B、-92.4 kJ/mol<△H1<△H2 |
| C、△H1<△H2<-92.4 kJ/mol |
| D、△H1=△H2<-92.4 kJ/mol |
下列说法中不正确的是( )
| A、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
| B、所有的糖、油脂、蛋白质都能水解,但水解产物不同 |
C、1mol的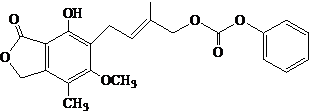 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( 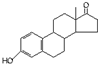 )比雌酮( )比雌酮(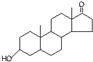 )多消耗3mol O2. )多消耗3mol O2. |
下列有关工业生产的叙述正确的是( )
| A、接触法制硫酸中采用沸腾炉的目的是为了使硫磺或黄铁矿燃烧充分,提高原料的利用率 |
| B、合成氨生产过程中采用高温高压条件都是为了提高N2、H2的转化率 |
| C、硫酸工业中,在接触室安装热交换器是为了利用硫磺或黄铁矿燃烧时放出的热量 |
| D、在联合制碱法中,参与循环的物质有CO2和NH3 |
可逆反应aA(g)+bB(g)?cC(g),改变温度(其他条件不变)、压强(其他条件不变)对上述反应正、逆反应速率的影响分别如图所示,以下叙述正确的是( )


| A、b>c,正反应为放热反应 |
| B、b<c,正反应为吸热反应 |
| C、a+b>c,正反应为放热反应 |
| D、a+b<c,正反应为吸热反应 |
下列关于NO与NO2的叙述正确的是( )
| A、常温下都是无色气体 |
| B、常温下都难溶于水 |
| C、一定条件下,可相互转化 |
| D、都可用排水法收集 |
 【化学-选修3:物质结构与性质】
【化学-选修3:物质结构与性质】