题目内容
2.设NA为阿伏加德罗常数值.下列有关叙述错误的是( )| A. | 2.3 g Na在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NHs中含有的氢原子数目为0.75NA | |
| C. | 1 L 0.1 mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个CO2分子的质量为$\frac{44}{{N}_{A}}$g |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、求出氨气的物质的量,然后根据1mol氨气中含3molH原子来分析;
C、磷酸为中强酸,不能完全电离;
D、1mol二氧化碳的质量为44g,含NA个二氧化碳分子.
解答 解:A、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠转移0.1NA个电子,故A正确;
B、标况下5.6L氨气的物质的量为0.25mol,而1mol氨气中含3molH原子,故0.25mol氨气中含0.75NA个氢离子,故B正确;
C、磷酸为中强酸,不能完全电离,故溶液中的离子个数小于0.4NA个,故C错误;
D、1mol二氧化碳的质量为44g,含NA个二氧化碳分子,故NA个二氧化碳分子的质量之和为44g,故一个二氧化碳分子的质量为$\frac{44}{{N}_{A}}g$,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列有关物质分类正确的是( )
| 选项 | 类别 | 物质 |
| A | 碱性氧化物 | Na2O2 CuO MgO |
| B | 难溶性物质 | Ba(OH)2 MgSO4 Na2SiO3 |
| C | 弱酸 | H2S H2SO4 CH3COOH |
| D | 强电解质 | AgCl MgSO4 CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
13.下列物质见光不会分解的是( )
| A. | HClO | B. | HNO3 | C. | AgI | D. | NaHCO3 |
10.下列说法正确的是( )
| A. | 核聚变如${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,因为有新微粒生成,所以该变化是化学变化 | |
| B. | 电子层数越多,半径越大 | |
| C. | 共价化合物分子间均存在分子间作用力 | |
| D. | H2O的稳定性大于H2S,是因为水分子间存在氢键 |
17.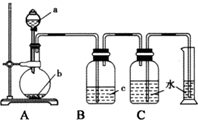 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.下列关于化学键的叙述中,正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | B. | 离子化合物中可能含有共价键 | ||
| C. | 共价化合物中可能含有离子键 | D. | 共价键只存在于共价化合物中 |
14.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 实验室制备Cl2可用排饱和食盐水集气法收集 | |
| C. | 液氯、氯水均为含多种分子和离子的混合物 | |
| D. | 1.12 L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数) |
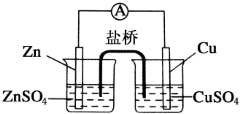 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空: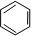 ;一种常见的烃的含氧衍生物:
;一种常见的烃的含氧衍生物: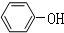 .
.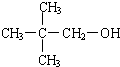 .
.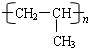 .
.