题目内容
5.属于纯净物的是( )| A. | 盐汽水 | B. | 矿泉水 | C. | 自来水 | D. | 蒸馏水 |
分析 同种物质组成的为纯净物,不同物质组成的为混合物,据此分析选项中物质组成和分类.
解答 解:A.盐汽水是不同物质组成的混合物,故A错误;
B.矿泉水是不同物质组成的混合物,故B错误;
C.自来水含多种物质属于混合物,故C错误;
D.蒸馏水是一种物质组成的为纯净物,故D正确;
故选D.
点评 本题考查了物质分类、物质组成,掌握概念实质是解题关键,题目难度不大.

练习册系列答案
相关题目
16.运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
①当弱酸的浓度一定时,降低温度,K值变小(填“变大”“变小”或“不变”).
②下列离子方程式和有关说法错误的是ac.
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2═2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-═2HCO3-+SO32-
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O.若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是ad.
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①2CH3OH(g)?CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g)?CH3OH(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的化学平衡常数K=K1K22K3(用含K1、K2、K3的代数式表示).向某固定体积的密闭容器中加入3mol CO和3mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的$\frac{1}{2}$,则CO的转化率为75%.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是ac.
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2═2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-═2HCO3-+SO32-
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O.若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是ad.
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①2CH3OH(g)?CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g)?CH3OH(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的化学平衡常数K=K1K22K3(用含K1、K2、K3的代数式表示).向某固定体积的密闭容器中加入3mol CO和3mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的$\frac{1}{2}$,则CO的转化率为75%.
13.下列物质见光不会分解的是( )
| A. | HClO | B. | HNO3 | C. | AgI | D. | NaHCO3 |
10.下列说法正确的是( )
| A. | 核聚变如${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,因为有新微粒生成,所以该变化是化学变化 | |
| B. | 电子层数越多,半径越大 | |
| C. | 共价化合物分子间均存在分子间作用力 | |
| D. | H2O的稳定性大于H2S,是因为水分子间存在氢键 |
17.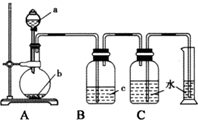 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
14.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 实验室制备Cl2可用排饱和食盐水集气法收集 | |
| C. | 液氯、氯水均为含多种分子和离子的混合物 | |
| D. | 1.12 L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数) |
14.下列各组物质在溶液中能大量共存的是( )
| A. | FeCl3 Na2SO4 HCl | B. | NaOH NaCl HNO3 | ||
| C. | CuSO4 NaNO3 KOH | D. | Na2CO3 HCl Ca(OH)2 |
 (1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH
(1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH