题目内容
6.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等,其中正确的是( )| A. | ①②③ | B. | ②③ | C. | ② | D. | ③ |
分析 同温同压下、等体积N2和CO的分子数目相等、物质的量相等,根据m=nM判断质量关系,同温同压下气体的密度之比等于摩尔质量之比.
解答 解:同温同压下、等体积N2和CO的分子数目相等,则物质的量相等,二者摩尔质量相等,根据m=nM可知,二者质量相等,同温同压下气体的密度之比等于摩尔质量之比,而二者密度相等,
故选:A.
点评 本题考查阿伏伽德罗定律及其推论,比较基础,注意根据PV=nRT理解掌握阿伏伽德罗定律及其推论.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
20.实现下列变化时,需克服相同类型作用力的是( )
| A. | 二氧化硅和干冰的熔化 | B. | 液溴和液汞的气化 | ||
| C. | 食盐和冰的熔化 | D. | 纯碱和烧碱的熔化 |
1.恒温下,在一密闭容器中,N2(g)+3H2(g)?2NH3(g)达到平衡后,测得c(H2)=2mol•L-1,N2的体积分数为20%,下列有关说法中正确的是( )
| A. | 将容器容积压缩一半,平衡向右移动,达到新平衡时c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移动,达到新平衡时N2的体积分数小于20% | |
| C. | 若达到新平衡时c(H2)=2.5mol•L-1,则改变的条件可能是降温或加压 | |
| D. | 若改变条件后,H2的百分含量增大,则平衡一定向逆反应方向移动 |
14. 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )| A. | 若将CH3COOH改为HCl,P点温度高于28℃ | |
| B. | 从M到N过程中c(H+)逐渐减小 | |
| C. | 混合溶液的导电能力:N>M | |
| D. | 实验的环境温度等于22℃ |
1.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最高的元素,Y是同周期中原子半径最大的元素,Z的最高氧化物的水化物能分别与Y和W的最高氧化的水化物反应生成盐和水,X与W同主族.下列说法不正确的是( )
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(W)<r(Z)<r(Y) | |
| C. | X的简单气态氢化物的热稳定性比W的强 | |
| D. | Z的最高价氧化物对应的水化物具有两性 |
18.下列实验装置不能达到实验目的是( )
| A. | 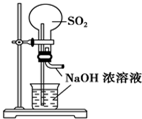 用SO2做喷泉实验 | B. | 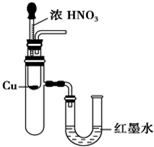 验证CU与浓HNO3反应的热量变化 | ||
| C. | 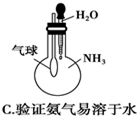 验证氨气易溶于水 | D. | 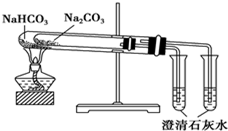 比较Na2CO3与NaHCO3的稳定性 |
15.下列操作不能达到实验目的是( )

| A. | ①检验某物质中是否含有钾元素 | B. | ②制备氢氧化亚铁并观察其颜色 | ||
| C. | ③分离水和乙醇 | D. | ④用CCl4萃取碘水中的碘 |
16.关于下列各装置图的叙述中,正确的是( )


| A. | 若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②是原电池,工作时SO42-离子向铜极移动 | |
| C. | 装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| D. | 装置④可用于实验室配置一定物质的量浓度的稀硫酸 |