题目内容
14. 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )| A. | 若将CH3COOH改为HCl,P点温度高于28℃ | |
| B. | 从M到N过程中c(H+)逐渐减小 | |
| C. | 混合溶液的导电能力:N>M | |
| D. | 实验的环境温度等于22℃ |
分析 A.P点是醋酸和氢氧化钠溶液体积都是25ml,恰好完全反应,生成醋酸钠溶液中水解显碱性,醋酸是弱酸电离过程为吸热过程;
B.图象分析可知,用醋酸滴入氢氧化钠反应,直到恰好反应生成醋酸钠,继续滴入酸过量,所以溶液中氢离子浓度增大;
C.M点是氢氧化钠多,N点是醋酸多,醋酸是弱电解质部分电离;
D.图象分析,加入10ml醋酸温度为22°C,说明当未加入醋酸时温度低于22°C.
解答 解:A.P点是醋酸和氢氧化钠溶液体积都是25ml,恰好完全反应生成醋酸钠,溶液中醋酸根离子水解显碱性,此时P点温度为28°C,醋酸是弱酸电离过程为吸热过程,若若将CH3COOH改为HCl,P点温度高于28℃,故A正确;
B.V1+V2=50mL,用醋酸滴入氢氧化钠反应,直到恰好反应生成醋酸钠,继续滴入酸过量,所以溶液中氢离子浓度增大,故B错误;
C.M点是氢氧化钠多,N点是醋酸多,醋酸是弱电解质部分电离,混C、M点是氢氧化钠多,N点是醋酸多,醋酸是弱电解质部分电离,混合溶液的导电能力:M>N,故C错误;
D.图象分析,加入10ml醋酸反应后,温度为22°C,说明当未加入醋酸时温度低于22°C,实验的环境温度低于22℃,故D错误;
故选A.
点评 本题考查了酸碱中和反应的过程分析和热量变化判断,注意弱电解质存在电离平衡时吸热过程,掌握基础是关键,题目难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
9.下列气体属于无色、无味、有毒的气体是( )
| A. | CO | B. | SO2 | C. | CO2 | D. | H2S |
2.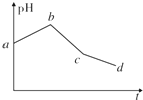 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
19.下列有关说法正确的是( )
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
6.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等,其中正确的是( )
| A. | ①②③ | B. | ②③ | C. | ② | D. | ③ |
3.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:S2-、K+、SO32-、Br- | |
| C. | Na2S溶液中:SO42-、K+、Cl-、Al3+ | |
| D. | pH=12的溶液中:NO3-、I-、Na+、Al3+ |
4.下面表格中的实验操作、实验现象和结论均正确且相符的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性 |
| B | 将盐酸缓缓滴入Na2CO3溶液中 | 有气泡产生 | 二者不反应 |
| C | 向某溶液中加入浓NaOH溶液并加热,在试管口用湿润红色石蕊纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | 向氢氧化铁胶体中滴加氯化铵饱和溶液 | 产生沉淀 | 沉淀为FeCl3 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
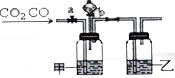 某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).
某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).