题目内容
1.恒温下,在一密闭容器中,N2(g)+3H2(g)?2NH3(g)达到平衡后,测得c(H2)=2mol•L-1,N2的体积分数为20%,下列有关说法中正确的是( )| A. | 将容器容积压缩一半,平衡向右移动,达到新平衡时c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移动,达到新平衡时N2的体积分数小于20% | |
| C. | 若达到新平衡时c(H2)=2.5mol•L-1,则改变的条件可能是降温或加压 | |
| D. | 若改变条件后,H2的百分含量增大,则平衡一定向逆反应方向移动 |
分析 A、将容器容积压缩一半,所有物质的浓度都增大;
B、在可逆反应中增加一种反应物的浓度,可以提高另一种反应物的转化率,而自身的转化率下降,所以氮气的体积分数大于20%;
C、由于该反应为气体体积减小的放热反应,降温会使平衡向正反应方向移动,氢气的浓度减小;
D、H2的百分含量增大,则平衡一定向逆反应方向移动,据此判断;
解答 解:A、将容器容积压缩一半,所有物质的浓度都增大,故A错误;
B、在可逆反应中增加一种反应物的浓度,可以提高另一种反应物的转化率,而自身的转化率下降,所以氮气的体积分数大于20%,故B错误;
C、由于该反应为气体体积减小的放热反应,降温会使平衡向正反应方向移动,氢气的浓度减小,故C错误;
D、H2的百分含量增大,则平衡一定向逆反应方向移动,故D正确;
故选D.
点评 本题考查了影响化学平衡移动的因素,掌握基础是关键,题目难度中等,注意增大一种反应物浓度,平衡向正反应方向移动,但该物质在体系中体积分数增大,加本题的易错点.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
9.下列气体属于无色、无味、有毒的气体是( )
| A. | CO | B. | SO2 | C. | CO2 | D. | H2S |
16.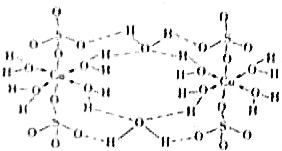 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
2.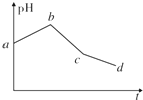 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
6.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等,其中正确的是( )
| A. | ①②③ | B. | ②③ | C. | ② | D. | ③ |
7.某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,下列说法正确的是( )
| A. | 水的电离程度不变 | B. | pH值变大 | ||
| C. | 稀释过程中,所有离子浓度均变小 | D. | 稀释过程中Kw逐渐变小 |
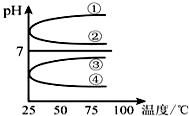 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).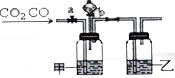 某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).
某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).