题目内容
20.实现下列变化时,需克服相同类型作用力的是( )| A. | 二氧化硅和干冰的熔化 | B. | 液溴和液汞的气化 | ||
| C. | 食盐和冰的熔化 | D. | 纯碱和烧碱的熔化 |
分析 A、二氧化硅是原子晶体和干冰是分子晶体;
B、溴气化破坏分子间作用力,汞气化破坏金属键;
C、食盐是离子晶体和冰是分子晶体;
D、纯碱和烧碱都是离子晶体.
解答 解:A、二氧化硅的熔化克服的共价键和干冰的熔化克服分子间作用力,故不选;
B、溴气化破坏分子间作用力,汞气化破坏金属键,故不选;
C、食盐的熔化克服的离子键和冰熔化克服分子间作用力,故不选;
D、纯碱和烧碱都是离子晶体熔化都是克服的离子键,故选;
故选D.
点评 本题考查晶体的类型和微粒间作用力的判断,题目难度不大,注意物质发生变化时粒子间作用力的变化.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
10.能正确表示下列反应的离子方程式的是( )
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Fe(NO3)3溶液中通入足量HI气体:2Fe3++2I-═2Fe2++I2 | |
| C. | 向NaHCO3溶液中滴入少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向水玻璃溶液中通入过量CO2:SiO32-+H2O+CO2═CO32-+H2SiO3↓ |
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
5.下表列出了①~⑨九种元素在周期表中的位置.
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为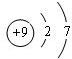 .
.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为
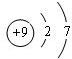 .
.(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
9.下列气体属于无色、无味、有毒的气体是( )
| A. | CO | B. | SO2 | C. | CO2 | D. | H2S |
6.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等,其中正确的是( )
| A. | ①②③ | B. | ②③ | C. | ② | D. | ③ |
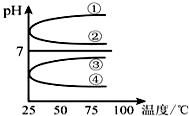 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号). 和
和  D、35Cl和37Cl
D、35Cl和37Cl