题目内容
20.恒温下,将a mol N2与b mol H2的混合气体通入一个V升固定容积的密闭容器中,发生如下反应:N2 (g)+3H2(g)═2NH3(g)(1)若反应进行到t分钟时,nt(N2)=13mol,nt(NH3)=6mol,计算a=16,反应速率V(H2)=$\frac{9}{Vt}$ mol•L-1•min-1.
(2)下列描述中能表明反应已达到平衡状态的是③.
①混合气体的压强不变 ②混合气体的密度不变 ③混合气体的平均摩尔质量不变
④容器内N2,H2,NH3的浓度之比为1:3:2 ⑤单位时间内生成n mol NH3,同时生成N2,H2共2n mol
(3)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量n(NH3)=8mol,N2和H2的转化率之比,α(N2):α(H2)=1:2.(写最简整数比)
分析 (1)根据生成氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量,t时刻时氮气的物质的量与参加反应的氮气的物质的量之和为a的值;根据v=$\frac{\frac{△n}{V}}{△t}$计算出用氨气表示的反应速率,然后利用化学反应速率与化学计量数成正比计算出用氢气表示的反应速率;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,然后计算出达到平衡时N2和H2的转化率,最后计算出N2和H2的转化率之比.
解答 解:(1)反应进行到t时,测的N2为13mol,NH3为6mol,由方程式可知,参加反应的氮气的物质的量为:6mol×$\frac{1}{2}$=3mol,故氮气的起始物质的量为:13mol+3mol=16mol,即a=16;
nt(NH3)=6mol,则用氨气表示的平均反应速率为:v(NH3)=$\frac{\frac{6mol}{VL}}{tmin}$=$\frac{6}{Vt}$mol•L-1•min-1,根据反应速率与化学计量数成正比可知,v(H2)=$\frac{3}{2}$v(NH3)=$\frac{9}{Vt}$mol•L-1•min-1,
故答案为:16;$\frac{9}{Vt}$;
(2)①该反应为气体体积缩小的反应,反应过程中压强发生变化,当混合气体的压强不变时,表明正逆反应速率相等,达到了平衡状态,故①错误;
②反应前后气体的体积和总质量不变,则混合气体的密度始终不变,不能根据密度判断平衡状态,故②错误;
③该反应气体气体的总质量不变,气体总物质的量发生变化,则混合气体的平均摩尔质量发生变化,当平均摩尔质量不变时,表明该反应已经达到平衡状态,故③正确;
④容器内N2,H2,NH3的浓度之比为1:3:2,无法判断各组分的浓度是否变化,则无法判断是否达到平衡状态,故④错误;
⑤单位时间内生成n mol NH3,同时生成N2,H2共2n mol,无法判断氮气、氢气的物质的量,则无法判断平衡状态,故⑤错误;
故答案为:③;
(3)反应达平衡时,混合气体为:$\frac{716.8L}{22.4L/mol}$=32mol,其中NH3的物质的量为:32mol×25%=8mol;
利用差量法计算:
N2 (g)+3H2(g)?2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 8mol 8mol
故原混合气体为:32mol+8mol=40mol,
由(1)知a=16mol,则b=40mol-16mol=24mol,
达到平衡时,N2和H2的转化率之比α(N2):α(H2)=$\frac{4mol}{16mol}$:$\frac{12mol}{24mol}$=1:2,
故答案为:1:2.
点评 本题考查了化学平衡的计算,题目难度中等,涉及转化率、化学平衡状态、化学反应速率等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及化学计算能力.

 走进文言文系列答案
走进文言文系列答案| A. | 1molC2H6中含有6 NA个共价键 | |
| B. | 7.8 g Na2O2中含有的阳离子数和阴离子数均为0.2NA | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 5.6g金属铁与足量盐酸反应时失去的电子数是0.3NA |
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02 mol•L-1AgNO3溶液和0.02 mol•L-1 Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
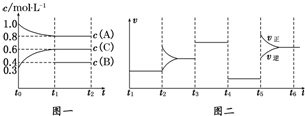
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |
| A. | 氨基酸 | B. | 醋酸 | C. | 小苏打 | D. | 酒精 |