题目内容
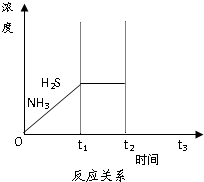 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为:
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可以回收硫.其电解总反应方程式(忽略氧的氧化还原)为
(3)一定温度下1mol NH4HS固体在定容真空容器中可部分分解为和氨气.
①该反应平衡常数表达式:
②当反应达平衡时,p氨气×p硫化氢=a(Pa2),则容器中的总压为
③该反应达到平衡状态的标志:
A、平均摩尔质量不变 B、气体的密度不变
C、硫化氢的体积分数不变 D、体系的温度不变
E、正反应速率不变 F、NH4HS的质量不变
④如图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到
平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)硫化氢与FeCl3溶液反应生成单质硫,H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质;
(2)类比电解氯化钠饱和溶液的电解反应,写出电解硫化钠溶液的电解反应方程式,根据产物来说明反应的优点;
(3)①NH4HS分解生成等量的硫化氢和氨气,依据平衡常数概念书写,注意固体不写入表达式;
②NH4HS分解生成等量的硫化氢和氨气,NH3与H2S的分压相同;
③结合反应特征,依据反应正逆反应速率相同,各组成含量保持不变分析选项;
④t2时增大氨气的浓度,达到新平衡时,氨的浓度比原平衡的浓度要高,且NH3与H2S浓度的降低比例是相同,据此来作图即可.
(2)类比电解氯化钠饱和溶液的电解反应,写出电解硫化钠溶液的电解反应方程式,根据产物来说明反应的优点;
(3)①NH4HS分解生成等量的硫化氢和氨气,依据平衡常数概念书写,注意固体不写入表达式;
②NH4HS分解生成等量的硫化氢和氨气,NH3与H2S的分压相同;
③结合反应特征,依据反应正逆反应速率相同,各组成含量保持不变分析选项;
④t2时增大氨气的浓度,达到新平衡时,氨的浓度比原平衡的浓度要高,且NH3与H2S浓度的降低比例是相同,据此来作图即可.
解答:
解:(1)H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,由于H2S是弱电解质,故书写离子方程式时,应写其分子式,即2Fe3++H2S═S↓+2Fe2++2H+,故答案为:2Fe3++H2S═S↓+2Fe2++2H+;
(2)电解硫化钠溶液的电解反应方程式为:Na2S+2H2O
S↓+H2↑+2NaOH,根据反应方程式可以得出:产物除硫单质外,还有H2和NaOH生成,所以该过程的优点是:副产物是氢气,生成的NaOH可循环利用;
故答案为:Na2S+2H2O
S↓+H2↑+2NaOH;副产氢气,生成的NaOH可循环利用;
(3)①NH4HS固体在定容真空容器中可部分分解为和氨气,NH4HS(s)=NH3↑+H2S↑,平衡常数K=[NH3][H2S];
故答案为:[NH3][H2S];
②NH4HS=NH3+H2S,由NH4HS分解的反应方程式可知:NH3与H2S的分压相同,故p硫化氢=p氨气=
Pa,所以平衡后的总压为p硫化氢+p氨气=2
Pa,故答案为:2
;
③NH4HS(s)=NH3↑+H2S↑,反应是气体体积增大的吸热反应
A、硫氢化铵是固体,反应过程中和平衡状态平均摩尔质量始终不变,不能说明反应达到平衡状态,故A不符合;
B、反应前后气体质量增多,气体的密度不变,说明反应达到平衡状态,故B符合;
C、反应过程中和平衡状态下,硫化氢的体积分数始终不变,故C不符合;
D、反应过程中一定伴随能量的变化,体系的温度不变,说明反应达到平衡状态,故D符合;
E、正反应速率不变,单位时间内生成气体浓度变化不变,说明反应达到平衡状态,故E符合;
F、NH4HS的质量不变说明反应达到平衡状态,故F符合;
故答案为:BDEF;
④t2时增大氨气的浓度,达到新平衡时,氨的浓度比原平衡的浓度要高,并且产生的氨气和硫化氢的量是相等的,所以NH3与H2S浓度的降低比例是相同的,即图象中的斜率相同,即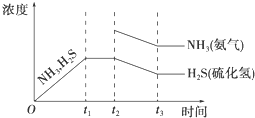 ;
;
故答案为: .
.
(2)电解硫化钠溶液的电解反应方程式为:Na2S+2H2O
| ||
故答案为:Na2S+2H2O
| ||
(3)①NH4HS固体在定容真空容器中可部分分解为和氨气,NH4HS(s)=NH3↑+H2S↑,平衡常数K=[NH3][H2S];
故答案为:[NH3][H2S];
②NH4HS=NH3+H2S,由NH4HS分解的反应方程式可知:NH3与H2S的分压相同,故p硫化氢=p氨气=
| a |
| a |
| a |
③NH4HS(s)=NH3↑+H2S↑,反应是气体体积增大的吸热反应
A、硫氢化铵是固体,反应过程中和平衡状态平均摩尔质量始终不变,不能说明反应达到平衡状态,故A不符合;
B、反应前后气体质量增多,气体的密度不变,说明反应达到平衡状态,故B符合;
C、反应过程中和平衡状态下,硫化氢的体积分数始终不变,故C不符合;
D、反应过程中一定伴随能量的变化,体系的温度不变,说明反应达到平衡状态,故D符合;
E、正反应速率不变,单位时间内生成气体浓度变化不变,说明反应达到平衡状态,故E符合;
F、NH4HS的质量不变说明反应达到平衡状态,故F符合;
故答案为:BDEF;
④t2时增大氨气的浓度,达到新平衡时,氨的浓度比原平衡的浓度要高,并且产生的氨气和硫化氢的量是相等的,所以NH3与H2S浓度的降低比例是相同的,即图象中的斜率相同,即
 ;
;故答案为:
 .
.
点评:本题涉及氧化还原反应、电化学、化学反应速率和平衡等方面的有关知识,综合性强,难度增大.

练习册系列答案
相关题目
下列各离子浓度的大小比较,正确的是( )
| A、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| B、常温时,将等体积的盐酸和氨水混合后pH=7,则c(NH4+)>c(Cl-) |
| C、0.2mol?L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.01mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
下列说法正确的是( )
| A、草酸氢钾溶液呈酸性,在0.1mol?L-1 KHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| B、在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、相同温度下,1mol?L-1氨水溶液与0.5mol?L-1氨水溶液中,c(OH-)之比是2:1 |
| D、当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
