题目内容
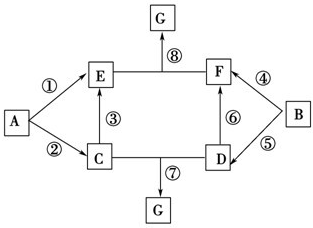 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).已知:①A、B为中学化学常见的金属单质,C~G均为化合物,并且E和G均含有3种元素;②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;④E和G焰色反应均呈黄色.
根据以上信息回答下列问题:
(1)写出下列物质的化学式:C
(2)①~⑥反应中,不属于氧化还原反应的是
(3)反应③的离子方程式为
(4)D和E溶液混合也可以生成G,反应的离子方程式为
考点:无机物的推断
专题:推断题
分析:C是淡黄色固体,应为Na2O2,则A为Na,E含有3种元素,应为NaOH,由钠和水反应生成,D既能与强酸溶液反应,又能与强碱溶液反应,应为Al2O3,则B为Al,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,应生成AgCl,说明F为AlCl3,由转化关系可知G为NaAlO2,以此解答该题.
解答:
解:C是淡黄色固体,应为Na2O2,则A为Na,E含有3种元素,应为NaOH,由钠和水反应生成,D既能与强酸溶液反应,又能与强碱溶液反应,应为Al2O3,则B为Al,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,应生成AgCl,说明F为AlCl3,由转化关系可知G为NaAlO2,
(1)由以上分析可知C为Na2O2,G为NaAlO2,故答案为:Na2O2;NaAlO2;
(2)①②③④⑤都有单质参加反应或有单质生成,一定属于氧化还原反应,⑥反应为Al2O3→AlCl3,可由Al2O3与盐酸反应生成,不是氧化还原反应,
故答案为:⑥;
(3)反应③为过氧化钠与水的反应,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)D和E溶液混合也可以生成G,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)由以上分析可知C为Na2O2,G为NaAlO2,故答案为:Na2O2;NaAlO2;
(2)①②③④⑤都有单质参加反应或有单质生成,一定属于氧化还原反应,⑥反应为Al2O3→AlCl3,可由Al2O3与盐酸反应生成,不是氧化还原反应,
故答案为:⑥;
(3)反应③为过氧化钠与水的反应,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)D和E溶液混合也可以生成G,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查无机物的推断,题目难度较大,本题注意根据反应的现象为突破口进行推断,学习中注意元素化合物的性质,注重相关知识的积累.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、大气污染物主要来自化石燃料和工业生产过程产生的废气 |
| B、形成酸雨的主要物质是硫氧化物和氮氧化物(NOX) |
| C、绿色化学的核心就是在生产过程中减少污染 |
| D、水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 |
C5H11Cl的同分异构体有( )种.
| A、7 | B、8 | C、9 | D、10 |
反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.在不同温度时K1、K2的值如下表.
下列说法正确的是( )
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
| A、反应①是放热反应 |
| B、反应②是放热反应 |
| C、反应②在973K时增大压强,K2增大 |
| D、在常温下反应①一定能自发进行 |

 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.