题目内容
5.下列说法正确的是( )| A. | 16gO2所含的分子数为6.02×1023个 | |
| B. | 0.5molH2SO4含有的原子数目为3.5NA | |
| C. | 18gH2O中原子的物质的量为1mol | |
| D. | 22g物质A中含有分子数为3.01×1023,则A的摩尔质量为44g |
分析 A、分子个数N=$\frac{m}{M}{N}_{A}$;
B、硫酸中含7个原子;
C、求出水的物质的量n=$\frac{m}{M}$,然后根据水为三原子分子来分析;
D、摩尔质量的单位为g/mol.
解答 解:A、分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{16g}{32g/mol}×{N}_{A}$=0.5NA,故A错误;
B、硫酸中含7个原子,故0.5mol硫酸中含3.5NA个原子,故B正确;
C、18g水的物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol,而水为三原子分子,故1mol水中含3mol原子,故C错误;
D、摩尔质量的单位为g/mol,故A的摩尔质量M=$\frac{m}{n}$=$\frac{m}{\frac{N}{{N}_{A}}}$=$\frac{22g}{\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}}$=44g/mol,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
15.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 氯化钠(硝酸钾) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ②③ | B. | ①③ | C. | 只有③ | D. | ③④ |
16.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
13.将等物质的量的Na、Na2O、Na2O2、NaOH放入等质量的足量水中制成NaOH溶液,编号依次是甲、乙、丙、丁,所得的溶液中溶质的质量分数的说法正确的是( )
| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
20.亚硝酸盐参加反应时,既可作氧化剂,也可作还原剂,当它作氧化剂时,可能的产物是( )
| A. | NH4 | B. | N2 | C. | N2O5 | D. | N2O3 |
3.汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如图.下列分析错误的是( )


| A. | 洗涤粗汞可用5%的盐酸代替5%的硝酸 | |
| B. | 辰砂与氧化钙加热反应时,CaSO4为氧化产物 | |
| C. | “灼烧辰砂法”过程中电子转移的方向和数目可表示为: | |
| D. | 减压蒸馏的目的是降低汞的沸点,提高分离效率 |
10.下列物质中,既含有共价键又含有离子键的是( )
| A. | HF | B. | NaCl | C. | HCl | D. | KOH |
7.从柑橘中提取得到结构简式如图所示的化合物,则下列有关它的推断错误的是( )
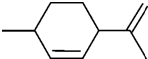

| A. | 属于芳香烃,分子式为C10H16 | B. | 常温下呈液态,比水轻 | ||
| C. | 其一氯代物有8种(不考虑顺反异构) | D. | 能与溴水发生加成反应 |
8.将32g CuO热到900℃,CuO部分分解为Cu2O,最后固体质量为31.2g.则未分解的CuO与分解的CuO的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |