题目内容
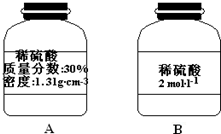
19.(1)西班牙的瑞奥汀托河是一条酸河,河水中含有硫酸亚铁和硫酸.经调查发现,这是由于上游河床含有黄铁矿(FeS2,铁为+2价),在水中氧的作用下,发生了反应:2FeS2+7O2+2H2O═2FeSO4+2H2SO4.反应中FeS2是还原剂,氧化产物是FeSO4、H2SO4,当有1molFeS完全反应时,转移的电子数14mol.(2)某同学打算用稀硫酸与金属锌反应制备标准状况下的氢气224ml,为防止硫酸过量而造成浪费,实验中应需要硫酸0.01mol.实验室现有一瓶稀硫酸如图A所示,B为空瓶,若利用A瓶中的稀硫酸配制B瓶上标签所示稀硫酸200ml,需要准备的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和200mL容量瓶,所需A瓶中稀硫酸的体积100.0mL.

分析 (1)所含元素化合价升高的反应物为还原剂,发生氧化反应得到氧化产物,所含元素化合价降低的反应物为氧化剂,发生还原反应得到还原产物;
FeS2完中Fe元素化合价不变,S元素化合价由-1价升高为硫酸、硫酸亚铁中的+6价;
(2)Zn与硫酸反应生成硫酸锌与氢气,根据H原子守恒计算需要硫酸物质的量;
还需要200mL容量瓶,根据n=cV计算硫酸的物质的量,根据c=$\frac{1000ρω}{M}$计算30%稀硫酸的物质的量浓度,再根据V=$\frac{n}{c}$计算需要30%硫酸的体积.
解答 解:(1)FeS2完中Fe元素化合价不变,S元素化合价由-1价升高为硫酸、硫酸亚铁中的+6价,FeS2是还原剂,氧化产物是FeSO4、H2SO4,当有1mol FeS2完全反应时,转移的电子为1mol×2×[6-(-1)]=14mol,
故答案为:还原;FeSO4、H2SO4;14;
(2)Zn与硫酸反应生成硫酸锌与氢气,生成氢气为$\frac{0.224L}{22.4L/mol}$=0.01mol,根据H原子守恒:n(H2SO4)=n(H2)=0.01mol,
还需要200mL容量瓶,需要硫酸的物质的量为0.2L×2mol/L=0.4mol,根据c=$\frac{1000ρω}{M}$可知,30%稀硫酸的物质的量浓度为$\frac{1000×1.31×30%}{98}$mol/L≈4mol/L,故需要30%硫酸的体积为$\frac{0.4mol}{4mol/L}$=0.1L=100.0mL,
故答案为:0.01;200mL容量瓶;100.0mL.
点评 本题考查氧化还原反应、一定物质的量浓度溶液配制,属于拼合型题目,注意根据化合价理解氧化还原反应基本概念,注意电子转移守恒在氧化还原反应计算中应用,根据c=$\frac{n}{V}$理解溶液配制原理.

| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
①CH2=CH2+PbCl2+H2O→CH3CHO+2HCl+Pb;
②Pb+2CuCl2→PbCl2+2CuCl2;
③2CuCl2+$\frac{1}{2}$O2+2HCl→2CuCl2+H2O.
下列叙述中正确的是( )
| A. | CH2=CH2是还原剂,PbCl2是氧化剂 | B. | CuCl2是还原剂,O2是氧化剂 | ||
| C. | 乙烯是还原剂,O2是氧化剂 | D. | PbCl2和CuCl2都是氧化剂 |