题目内容
7.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体.
(1)加入H2O2的目的是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式解释)
(2)常采用下列方法测定硫酸镁晶体中MgSO4 的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物.
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL.
计算该晶体中MgSO4的质量分数为32%.
分析 (1)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,据此书写离子方程式;
(2)在pH在9~10之间溶液A中,可以通过锌离子的物质的量计算出剩余EDTA的物质的量,调节pH在5~6时,通过锌离子的物质的量可计算出总EDTA的物质的量,由此可计算出与镁离子反应的EDTA的物质的量,根据$\frac{镁离子的质量}{样品的质量}$×100%计算出Mg2+的质量分数;
解答 解:(1)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)Mg2+、Zn2+与EDTA均按1:1反应,在25mL溶液A中:n(EDTA)=n(Zn2+)=0.10×20.00×10-3=2.00×10-3mol
则100mL溶液A中剩余EDTA的量:n(EDTA)=2.00×10-3×100/25=8.00×10-3mol
25mL溶液A中EDTA的量:n(EDTA)总=n(Zn2+)=0.10×30.00×10-3=3.00×10-3mol
则100mL溶液A中EDTA总量:n(EDTA)总=3.00×10-3×4=0.0120mol
所以与1.5g样品中镁离子反应的EDTA的物质的量为0.012mol-8.00×10-3 mol=0.004mol,所以样品中n(Mg2+)=0.004mol,硫酸镁其质量为0.004mol×120g/mol=0.48g,
则该结晶硫酸镁中Mg2+的质量分数为=$\frac{0.48g}{1.5g}$×100%=32%,
故答案为:32%;
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.

| A. | H2CO3 H2SiO3 H3PO4 | B. | HNO3 H3PO4 H2SO4 | ||
| C. | HI HBr HCl | D. | HClO HNO3 HClO4 |
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3+3H+ 明矾净水 | |
| C. | Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ 制备Fe(OH)3胶体 | |
| D. | SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
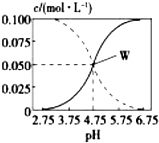 25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )| A. | pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)=c(CH3COOH) | |
| C. | pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L | |
| D. | 据图象可求得该温度下CH3COOH的电离常数Ka=10-4.75 |
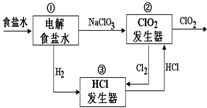 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑,
装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$2ClO2+Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
| A. |  检验装置气密性 | B. |  验证溴乙烷发生消去反应生成乙烯 | ||
| C. |  测定中和热 | D. |  从碘的CCl4溶液中分离出碘 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
