题目内容
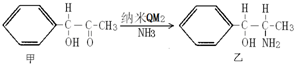
4.(1)在容量为50毫升的锥形瓶中放入一定量的NH4Cl晶体,用适量的水配成约20毫升饱和NH4Cl溶液.然后向溶液中投入少量镁粉,使其充分反应①试分析本实验可观察到的现象:生成白色沉淀,有气泡冒出
②写出有关离子方程式:NH4++H2O?NH3•H2O+H+,Mg+2H+=Mg2++H2↑,Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+
(2)已知液体SO2和纯水的导电性相近,都能在一定程度上电离:2SO2?SO2++SO${\;}_{3}^{2-}$,在液态SO2中可用Cs2SO3去滴定SOCl2,发生反应方程式为:SO32-+SO2+=2SO2.
分析 (1)氯化铵溶解得到溶液中铵根离子水解溶液显酸性,加入镁粉和氢离子发生反应生成氢气,促进铵根离子水解生成的一水合氨浓度增大,结合镁离子形成氢氧化镁白色沉淀,所以同时得到氢氧化镁沉淀;
(2)根据液态SO2和水相似以及以水为溶剂进行中和滴定的原理.
解答 解:(1)①氯化铵溶解得到溶液中铵根离子水解溶液显酸性,加入镁粉和氢离子发生反应生成氢气,促进铵根离子水解生成的一水合氨浓度增大,结合镁离子形成氢氧化镁白色沉淀,所以同时得到氢氧化镁沉淀,
故答案为:生成白色沉淀,有气泡冒出;
②反应过程中的离子方程式为:铵根离子水解的离子方程式:NH4++H2O?NH3•H2O+H+,镁粉和氢离子反应生成氢气的离子方程式:Mg+2H+=Mg2++H2↑,镁离子结合一水合氨生成氢氧化镁白色沉淀的离子方程式为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,
故答案为:NH4++H2O?NH3•H2O+H+,Mg+2H+=Mg2++H2↑,Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+;
(2)因液态SO2和水相似,以水为溶剂进行中和滴定的原理为:H3O++OH-=2H2O,所以用Cs2SO3滴定SOCl2的原理为:SO32-+SO2+=2SO2,
故答案为:SO32-+SO2+=2SO2.
点评 本题考查了盐类水解原理的分析,主要以水的电离平衡为背景,以信息的形式考查了液态SO2自离解,难度不大,但要抓住信息,理解信息是关键.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
12.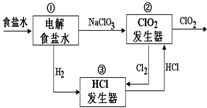 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,
装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑,
装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$2ClO2+Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑,
装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$2ClO2+Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
13.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18 g H216O和20 g H218O含有的质子数均为10NA | |
| B. | 1L 1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
12.已知下列热化学方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则14gCO气体与足量FeO充分反应得到Fe单质和CO2气体时的反应热为( )
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则14gCO气体与足量FeO充分反应得到Fe单质和CO2气体时的反应热为( )
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
9.下列说法正确的是( )
| A. | 丙烷的比例模型是 | |
| B. |  与 与 互为同系物 互为同系物 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
13.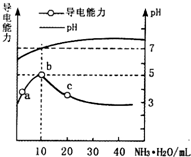 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |

 )
)
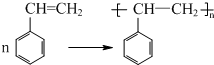 (不要求写出反应条件)
(不要求写出反应条件)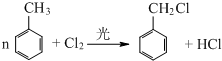 (要求写出反应条件)
(要求写出反应条件)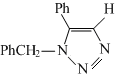 .
.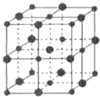 已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.