题目内容
8.25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A.铵根离子的积少成多较小,则c(NH4+)>c(SO42-);
B.反应后溶质为等浓度的醋酸钠、醋酸和氯化钠,混合液呈酸性,则醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH);
C.醋酸为弱酸,混合液中醋酸过量,则溶液呈酸性:c(H+)>c(OH-),结合电荷守恒可知c(CH3COO-)>c(Na+);
D.加入盐酸后碳酸氢根离子与氢离子反应生成二氧化碳气体,导致溶液中含有的C元素减少.
解答 解:A.0.1 mol•L-1( NH4)2SO4溶液中,由于铵根离子的积少成多较小,则c(NH4+)>c(SO42-),所以正确的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合,所得溶液为酸性,则c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒c(CH3COO-)+c(CH3COOH)=2c(Cl-)可知c(CH3COO-)>c(Cl-)>c(CH3COOH),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中,醋酸为弱酸,则混合液中醋酸过量,混合液显示酸性,则:c(H+)>c(OH-),结合电荷守恒可知c(CH3COO-)>c(Na+),所以c(CH3COO-)+c(H+)>c(Na+)+c(OH-),故C正确;
D.向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中,由于部分C元素生成二氧化碳气体,则:c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用,D为易错点,注意部分碳元素转化成二氧化碳气体,试题培养了学生的灵活应用能力.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3+3H+ 明矾净水 | |
| C. | Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ 制备Fe(OH)3胶体 | |
| D. | SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
| A. |  检验装置气密性 | B. | 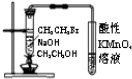 验证溴乙烷发生消去反应生成乙烯 | ||
| C. |  测定中和热 | D. | 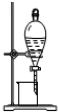 从碘的CCl4溶液中分离出碘 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{蒸发}{→}$无水MgCl2 | |
| D. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 |
| A. | 18 g H216O和20 g H218O含有的质子数均为10NA | |
| B. | 1L 1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |

