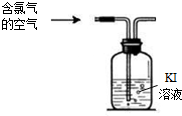
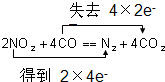题目内容
20.氨分解反应2NH3?N2+3H2在容积为2L的密闭容器内进行.已知起始时氨气的物质的量为4mol,5s时为2.4mol,则此时间段内用氮气的浓度变化表示该反应的平均速率为( )| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
分析 先计算氨气浓度变化量,然后根据物质的变化浓度之比等于化学计量数之比求出氮气的浓度变化量,最后根据v=$\frac{△c}{△t}$计算反应的速率.
解答 解:起始时氨气的物质的量为4mol,5s时为2.4mol,氨气浓度变化量为(4mol-2.4mol)÷2L=0.8mol/L,物质的变化浓度之比等于化学计量数之比,所氮气的浓度变化为0.4mol/L,则用氮气表示该反应的速率v=$\frac{△c}{△t}$=$\frac{0.4mol/L}{5s}$=0.08mol/(L•s),故选D.
点评 本题考查化学反应速率有关计算,比较基础,常用方法有定义法与化学计量数比值法,根据情况选择合适的计方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列离子反应方程式正确的是( )
| A. | 向Ca(ClO)2溶液中通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO3↓+Cl-+2HClO | |
| B. | 1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O |
5.如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 若 Zn与该硫酸反应消耗13克Zn,一定产生4.48升气体 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
12.下列叙述中,正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等物质的量的Cl2和HCl所含的分子数必相等 | |
| C. | 1LHCl气体一定比1L Cl2气体的质量小 | |
| D. | 22.4LHCl气体的物质的量恰好是11.2LHCl气体的物质的量的二倍 |
9.下列说法不正确的是( )
| A. | 元素是具有相同核电荷数的同一类原子的总称 | |
| B. | 核素代表一类原子 | |
| C. | 某元素的一种核素代表该元素的一种原子 | |
| D. | 某种同位素或核素代表该元素的一种原子 |
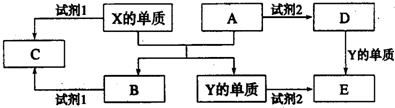
 氯气及其相关产品在生活、生产中应用广泛.
氯气及其相关产品在生活、生产中应用广泛.