题目内容
10.汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物.其反应式可表示为:2NO2+4CO═N2+4CO2①用双线桥法标出上述反应电子转移的方向和数目:
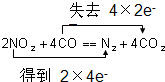
②每有28g N2生成,反应中转移的电子为8mol.
分析 2NO2+4CO═N2+4CO2中,N元素的化合价降低,C元素的化合价升高,该反应转移8e-,结合n=$\frac{m}{M}$及元素的化合价变化计算转移电子.
解答 解:①在反应2NO2+4CO═N2+4CO2中,N元素的化合价降低,由+4价→0价,C元素的化合价升高,由+2价→+4价,
反应中得失电子的数目等于化合价变化的数目,可表示为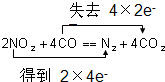 ,
,
故答案为: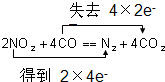 ;
;
②反应中氧化剂为NO2,还原剂为CO,n(N2)=$\frac{28g}{28g/mol}$=1mol,则转移电子的物质的量为2×(4-0)mol=8mol,故答案为:8.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意转移电子的计算方法,题目难度不大.

练习册系列答案
相关题目
20.氨分解反应2NH3?N2+3H2在容积为2L的密闭容器内进行.已知起始时氨气的物质的量为4mol,5s时为2.4mol,则此时间段内用氮气的浓度变化表示该反应的平均速率为( )
| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
1.某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
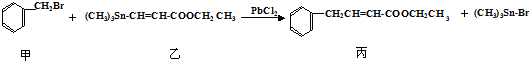
下列分析判断正确的是( )

下列分析判断正确的是( )
| A. | 分离提纯有机物丙宜在NaOH热溶液中进行 | |
| B. | PbCl2的作用是提高反应物的活性,加快反应速率 | |
| C. | 可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 | |
| D. | 利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
18.下列关于各反应类型的关系中,说法正确的是( )
| A. | 没有单质参加的化合反应一定不属于氧化还原反应 | |
| B. | 离子反应一定属于氧化还原反应 | |
| C. | 有的复分解反应属于氧化还原反应 | |
| D. | 置换反应一定属于氧化还原反应 |
5.下列反应的离子方程式书写不正确的是( )
| A. | 实验室制取氯气 MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 过量的氨水滴加到氯化铝溶液中 Al3++3NH3.H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+H++HClO | |
| D. | 小苏打溶液中加入过量石灰水2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
15.下列溶液中通入SO2后,最终一定会出现沉淀的是( )
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | 澄清石灰水 |
2.下列说法正确的是( )
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
19.下列卤代烃发生消去反应后只生成一种烯烃的是( )
| A. | CH3Cl | B. | (CH3)3CBr | C. | (CH3)3CCH2Cl | D. | (CH3)2CBrCH(CH3)2 |
4.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,其中X、Y同主族,Y、Z、W同周期,X-与氦原子电子层结构相同,Z原子最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是( )
| A. | X和Y能形成共价化合物 | |
| B. | Y与W形成的化合物Y2W2中含有离子键和共价键 | |
| C. | 简单离子的半径:Y>Z>W>X | |
| D. | 最高价氧化物对应水化物的酸性:Z>W |