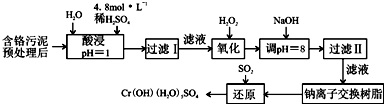
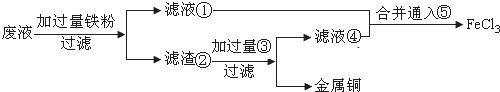
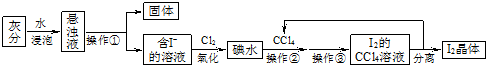
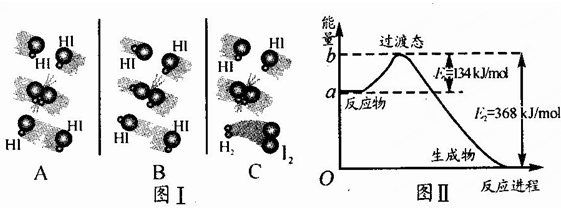
题目内容
(1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0mol、D为6.5mol、F为2.0mol,设E为x mol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:
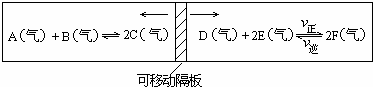
①若x=4.5,则右侧反应在起始时向 (填“正反应“或“逆反应“)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于 .
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填“相等“、“不相等“或“不能确定“).其理由是: .
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)=2mol?L-1,c(H2O)=3mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= ;
②在相同温度下,若起始时c(CO)=2mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则此时v(正) v(逆)(填“大于”“小于”或“等于”),达到平衡时CO的转化率为 ;
③若降低温度,该反应的K值将 (填“增大”“减小”或“不变”,下同),该反应的化学反应速率将 .

①若x=4.5,则右侧反应在起始时向
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)=2mol?L-1,c(H2O)=3mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
②在相同温度下,若起始时c(CO)=2mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则此时v(正)
③若降低温度,该反应的K值将
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,由此判断右边反应向哪个方向进行;
令达平衡时E的消耗量为2a摩,求出平衡时各组分的物质的量,利用反应混和物总的物质的量为12mol列出等式,再利用可逆反应反应物不能完全反应列不等式,联立求解.
②这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A的物质的量也不同;
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向;据①中的平衡常数,利用三段式法计算平衡时各物质浓度,计算转化率,据此解答;
③该反应是放热反应,降低温度,平衡向着正向移动,K值增大,反应速率减小.
令达平衡时E的消耗量为2a摩,求出平衡时各组分的物质的量,利用反应混和物总的物质的量为12mol列出等式,再利用可逆反应反应物不能完全反应列不等式,联立求解.
②这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A的物质的量也不同;
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向;据①中的平衡常数,利用三段式法计算平衡时各物质浓度,计算转化率,据此解答;
③该反应是放热反应,降低温度,平衡向着正向移动,K值增大,反应速率减小.
解答:
解:(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,x=4.5时右边开始总的物质的量为6.5mol+2.0mol+4.5mol=13mol,大于12mol,所以反应向体积减小的方向进行,即向正反应方向进行;
设达平衡时E的消耗量为2a mol.
D+?2E?2F,
起始(mol):6.5 x 2.0
变化(mol):a 2a 2a
平衡(mol):6.5-a x-2a 2.0+2a
因左侧反应混合物总的物质的量为12 mol所以达平衡时,右侧反应需满足:?
(6.5-a)+(x-2a)+(2.0+2a)=12 且 x-2a>0
即
解之得,x<7.0?
故答案为:正反应;7.0;
②两种情况下,反应到达平衡时反应混合物总的物质的量为12mol,所以这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A物质的量也不同.
故答案为:不相等;因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同;
(2)①平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
=1,
故答案为:1;
②在相同温度下(850℃),若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则:
CO(g)+H2O(g)═CO2(g)+H2 (g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 0.5
一段时间(mol/L):0.5 1.5 0.5 0.5
浓度商Qc=
=
<1,故平衡向正反应进行,此时v(正)>v(逆),
假设平衡时,转化的CO浓度为x,则有
CO(g)+H2O(g)═CO2(g)+H2 (g)
开始(mol/L):1 2 0 0
变化(mol/L):x x x x
一段时间(mol/L):1-x 2-x x x
相同温度下,化学平衡常数相同,有
=1
解的x=
,
CO的转化率α(CO)=
×100%=66.7%,
故答案为:大于;66.7%;
③温度降低,该反应是放热反应,化学平衡向着正向移动,二氧化碳和氢气浓度增大,一氧化碳和水的浓度减小,平衡常数K增大;降低温度,反应速率减小,
故答案为:增大;减小.
设达平衡时E的消耗量为2a mol.
D+?2E?2F,
起始(mol):6.5 x 2.0
变化(mol):a 2a 2a
平衡(mol):6.5-a x-2a 2.0+2a
因左侧反应混合物总的物质的量为12 mol所以达平衡时,右侧反应需满足:?
(6.5-a)+(x-2a)+(2.0+2a)=12 且 x-2a>0
即
|
解之得,x<7.0?
故答案为:正反应;7.0;
②两种情况下,反应到达平衡时反应混合物总的物质的量为12mol,所以这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A物质的量也不同.
故答案为:不相等;因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同;
(2)①平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
故答案为:1;
②在相同温度下(850℃),若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则:
CO(g)+H2O(g)═CO2(g)+H2 (g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 0.5
一段时间(mol/L):0.5 1.5 0.5 0.5
浓度商Qc=
| 0.5×0.5 |
| 0.5×1.5 |
| 1 |
| 3 |
假设平衡时,转化的CO浓度为x,则有
CO(g)+H2O(g)═CO2(g)+H2 (g)
开始(mol/L):1 2 0 0
变化(mol/L):x x x x
一段时间(mol/L):1-x 2-x x x
相同温度下,化学平衡常数相同,有
| x2 |
| (1-x)×(2-x) |
解的x=
| 2 |
| 3 |
CO的转化率α(CO)=
| 2 |
| 3 |
故答案为:大于;66.7%;
③温度降低,该反应是放热反应,化学平衡向着正向移动,二氧化碳和氢气浓度增大,一氧化碳和水的浓度减小,平衡常数K增大;降低温度,反应速率减小,
故答案为:增大;减小.
点评:本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等,(2)②中注意分析各物质的浓度变化量关系,确定概念改变的条件.难度中等,关键在于确定右侧反应到达平衡时反应混合物总的物质的量.

练习册系列答案
相关题目
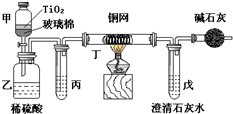 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: