题目内容
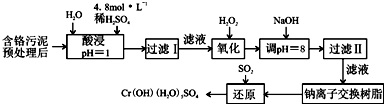
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下: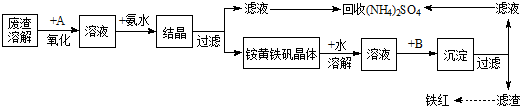
回答下列问题:
(1)在废渣溶解操作时,应选用 溶解(填编号).
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用 (供选择使用的有:空气、Cl2、MnO2),其理由是 .
(3)根据如图有关数据,你认为工业上氧化操作时应控制的条件是: .
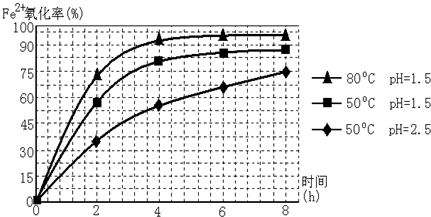
(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:
.

回答下列问题:
(1)在废渣溶解操作时,应选用
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用
(3)根据如图有关数据,你认为工业上氧化操作时应控制的条件是:

(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)依据废渣成分结合提纯物质组成分析判断;
(2)氧化剂主要是用来氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)依据铵黄铁矾溶液中铁离子和氨水反应生成氢氧化铁书写.
(2)氧化剂主要是用来氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)依据铵黄铁矾溶液中铁离子和氨水反应生成氢氧化铁书写.
解答:
解:(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子;
A、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D符合;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒且污染空气,引入了氯离子;二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4)因目的是制取氧化铁和硫酸铵,故往铵黄铁矾加入溶液B为氨水,至pH为5时产生沉淀,生成的是氢氧化铁沉淀反应离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+.
A、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D符合;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒且污染空气,引入了氯离子;二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4)因目的是制取氧化铁和硫酸铵,故往铵黄铁矾加入溶液B为氨水,至pH为5时产生沉淀,生成的是氢氧化铁沉淀反应离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+.
点评:本题考查了物质制备和提纯的实验流程分析判断,图象分析应用,化学方程式书写方法,题目信息量大需要仔细审题,题目难度中等.本题要注意从实验目的和分离除杂原则考虑,如滤渣溶解时加硫酸而不加盐酸,因目的是回收(NH4)2SO4,结合题设去看流程,不必对流程每一步都弄清楚,如:如何生成黄铁钒、如何生成硫酸铵等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、气体摩尔体积约为22.4L/mol |
| B、1mol H2O在标准状况下的体积约是22.4L |
| C、1mol甲烷和氧气的混合(任意比)气体在标准状况下的体积约为22.4L |
| D、1mol CO2在20℃时的体积一定比22.4L大 |
下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A、福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集溜出物 |
| B、乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液 |
| C、苯(苯酚):加NaOH溶液,充分振荡,分液,弃水层 |
| D、乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
以Al2O3为原料制取氢氧化铝,最好的方法是( )
| A、将Al2O3溶于水 |
| B、将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液 |
| C、将Al2O3先溶于盐酸中,之后滴加氨水 |
| D、将Al2O3先溶于NaOH溶液中,之后再滴加盐酸 |