题目内容
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:(1)若电解质溶液为稀硫酸,则Zn棒为原电池的
(2)若电解质为硫酸铜溶液,则Cu棒上发生
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)锌比铜活泼,若电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,发生还原反应;
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,铜极上发生还原反应,有铜析出.
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,铜极上发生还原反应,有铜析出.
解答:
解:(1)锌比铜活泼,若电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,发生还原反应,正极发生2H++2e-=H2↑,可观察到有气泡生成,
故答案为:负;有气泡生成(或有气体放出); 2H++2e-=H2↑;
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,电极方程式为Zn-2e-=Zn2+,铜极上发生还原反应,有铜析出,故答案为:还原;Zn-2e-=Zn2+.
故答案为:负;有气泡生成(或有气体放出); 2H++2e-=H2↑;
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,电极方程式为Zn-2e-=Zn2+,铜极上发生还原反应,有铜析出,故答案为:还原;Zn-2e-=Zn2+.
点评:本题考查原电池知识,侧重于学生的分析能力和基本理论的综合理解和运用的考查,为高频考点,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
在一密闭容器中,反应mA(g)+nB(g)?pC(g),达到平时,测得c(A)为0.5mol?L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol?L-1.则下列判断正确的是( )
| A、化学计量数:m+n>p |
| B、平衡向正反应方向移动了 |
| C、物质B的转化率减小了 |
| D、物质C的质量分数增加了 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、78 g Na2O2中含有的阴离子数为2NA |
| B、1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
下列各组离子中,在给定条件下能够大量共存的是( )
| A、通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | ||
| B、无色溶液中:Mg2+、MnO4-、SO42-、K+ | ||
C、
| ||
| D、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示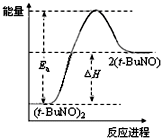 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |