题目内容
5. 纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )
纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应式为(CH2O)n-4ne-+n H2O=nCO2+4n H+ | |
| C. | 电子由b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧向右侧迁移 |
分析 正极上二氧化锰得电子生成锰离子,负极上(CH2O)n失电子生成二氧化碳,原电池中电子从负极向正极移动,溶液中阳离子向正极移动,据此分析.
解答 解:A.原电池中正极上发生得电子的氧化反应,所以a极为正极,正极上二氧化锰得电子生成锰离子,故A正确;
B.b为负极,负极上(CH2O)n失电子生成二氧化碳,则电极反应式为(CH2O)n-4ne-+n H2O=nCO2+4n H+,故B正确;
C.原电池中电子从负极向正极移动,即电子由b极流出经用电器流向a极,故C正确;
D.溶液中阳离子向正极移动,则放电时H+由质子交换膜左侧向右侧迁移,故D错误.
故选D.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
16.下列除杂方案合理的是( )
| A. | 除去苯中的少量苯酚:加浓溴水,过滤 | |
| B. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,过滤 | |
| C. | 除去甲醛中少量的乙烯:通过盛有溴水的洗气瓶,洗气 | |
| D. | 除去溴苯中少量的Br2:加入稍过量氢氧化钠,分液 |
13.对于反应3A+B=2C,下列说法正确的是 ( )
| A. | 某温度时,化学反应速率无论用A、C何种物质表示,其数值都是相同的 | |
| B. | 其他条件不变时,升高温度,反应速率加快 | |
| C. | 其他条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
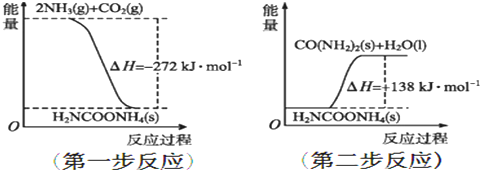
20.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化学反应的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是化学反应中发生能量变化的主要原因 | |
| C. | HCl(aq)和NaOH(aq)反应的中和热为57.3 kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1 mol H2O(l)时,放出的热量为57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol |
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol任何气体的体积都约是22.4 L | |
| B. | 18 g NH4+含有电子数为10NA | |
| C. | NA个H2SO4分子的质量等于H3PO4的摩尔质量 | |
| D. | 标准状况下,相同体积的O2、HCl含有的分子数都为NA |
17.将a克Fe2O3、Al2O3样品溶解在过量的400mL 0.1mol•L-1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH 溶液的浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |