题目内容
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A、原子半径:X>Y>Z |
| B、元素的非金属性:X>Y>Z |
| C、气态氢化物稳定性:X<Y<Z |
| D、原子序数:Z>Y>X |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:同周期的X、Y、Z三种元素,其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,由于同周期元素随原子序数增大,非金属性增强,故原子序数X>Y>Z,非金属性越强,气态氢化物越稳定,同周期元素随原子序数增大,原子半径减小,据此解答.
解答:
解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A.同周期从左到右非金属性增强,原子序数增大,原子半径逐渐减小,所以原子半径:X<Y<Z,故A错误;
B.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故B正确;
C.由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误;
D.非金属性X>Y>Z,同周期从左到右元素非金属性增强,可知原子序数的关系为X>Y>Z,故D错误;
故选B.
A.同周期从左到右非金属性增强,原子序数增大,原子半径逐渐减小,所以原子半径:X<Y<Z,故A错误;
B.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故B正确;
C.由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误;
D.非金属性X>Y>Z,同周期从左到右元素非金属性增强,可知原子序数的关系为X>Y>Z,故D错误;
故选B.
点评:本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

练习册系列答案
相关题目
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
将镁带投入盛放在敞口容器内的盐酸里,反应速率用产生的氢气的速率表示,在下列因素中:
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
| A、①④ | B、③⑤ |
| C、①②③⑤ | D、①②③ |
地球一小时是世界自然基金会应对全球气候变化所提出的一项倡议,以此来激发人们对保护地球的责任感,同时倡导节能减排理念.下列不能达到节能减排目的是( )
| A、利用太阳能分解水获得氢气 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、在农村推广建造沼气池 |
与图中相对应的叙述是( )
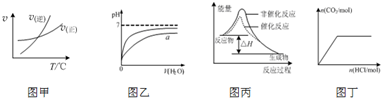

| A、由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 |
| B、图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C、图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D、图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
臭氧O3可以使湿润的淀粉碘化钾试纸变蓝,化学反应式为:2KI+O3+H2O=2KOH+I2+O2;下列叙述中正确的是( )
| A、O3在反应中被氧化成O2 |
| B、反应中氧化产物O2与还原产物I2的物质的量之比为1:1 |
| C、H2O是氧化剂 |
| D、该反应中的还原产物是KOH |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
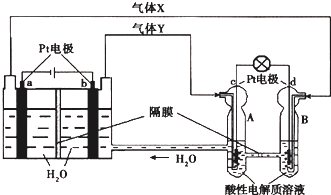

| A、当有0.1mol电子转移时,a极产生0.56L O2(标准状况下) |
| B、为了增加导电性可以将左边容器中的水改为食盐水 |
| C、c极上进行还原反应,B中的H+可以通过隔膜进入A |
| D、d极上发生的电极反应是:O2+4H++4e-═2H2O |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是( )
| A、a原子的最外层电子数比b原子的最外层电子数少 |
| B、把a、b两块金属片浸入稀硫酸中,用导线相连组成原电池时,电流由 a到b |
| C、1mol a从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多 |
| D、常温时,a能从水中置换出氢,而b不能 |
下列有关碱金属的叙述正确的是( )
| A、碱金属都可以保存在煤油中 |
| B、碱金属的金属性强弱为:Li<Na<K<Rb |
| C、随着原子序数的增加,碱金属的熔点增大 |
| D、碱金属着火应用泡沫灭火剂更好 |