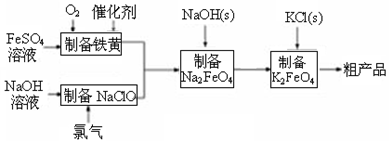
题目内容
15.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )| A. | 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| B. | 10g 46%的乙醇水溶液中所含氢原子数目为0.6NA | |
| C. | 标准状况下8.96L的平均相对分子质量为3.5的H2与D2含有中子数0.3NA | |
| D. | 1molCu与足量的S完全反应,转移电子数为2NA |
分析 A、NO2、N2O4的最简式均为NO2;
B、在乙醇溶液中,除了乙醇外,水分子也含H原子;
C、H2与D2的相对分子质量分别为2和4,根据十字交叉法求出两者的比例;
D、铜和硫单质反应后变为+1价.
解答 解:A、NO2、N2O4的最简式均为NO2,故23g混合气体中含有的NO2的物质的量为0.5mol,而在硝酸和铜反应时,氮元素的价态由+5价变为+4价,故当生成0.5molNO2 时硝酸得到0.5mol电子即0.5NA个,即铜失去0.5NA个电子,故A正确;
B、在乙醇溶液中,除了乙醇外,水分子也含H原子,故此溶液中含有的H原子个数多于0.6NA个,故B错误;
C、H2与D2的相对分子质量分别为2和4,根据十字交叉法可知H2与D2的物质的量之比为1:3,故8.96L即0.4mol的混合气体中H2的物质的量为0.1mol,而D2的物质的量为0.3mol,而H2中不含中子,D2中含2个中子,故0.3molD2中含0.6mol中子即0.6NA个,故C错误;
D、铜和硫单质反应后变为+1价,故1mol铜反应后转移1mol电子即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
相关题目
3.关于化学能与热能的叙述,正确的是( )
| A. | 需要加热才能发生的反应,一定是吸热反应 | |
| B. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| C. | 化学反应中的能量变化都表现为热量的变化 | |
| D. | 化学反应中的能量变化,主要是由化学键的变化引起的 |
4.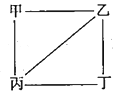 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
5.已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
 (6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气
(6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气