题目内容
5.在密闭容器中进行可逆反应:CO (气)+NO2 (气)?CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:(1)增大容器的体积,平衡不移动,反应混合物的颜色变浅.
(2)通入CO2气体,平衡左移,反应混合物的颜色变深.
分析 已知:CO(气)+NO2(气)?CO2(气)+NO(气)△H<0,反应的特征为反应前后气体的体积相等,则增大压强平衡不移动,增大反应物或生成物浓度时,平衡发生移动,以此解答该题.
解答 解:(1)反应前后气体的体积相等,则增大容器的体积平衡不移动,体积增大,浓度减小,则混合气体的颜色变浅,
故答案为:不移动;变浅;
(2)通入CO2气体,生成物浓度增大,平衡向左移动,混合物颜色变深,
故答案为:左移;变深.
点评 本题考查化学平衡的影响因素,为高考常见题型,侧重于学生的分析能力的考查,注意把握方程式的特征以及影响因素,学习中注意积累,难度不大.

练习册系列答案
相关题目
4.室温下,H2+Cl2$\stackrel{点燃}{→}$2HCl生成0.1molHCl,下列说法不正确的是( )
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
1.下列各组物质形成的溶液,不能用FeCl3作为鉴别试剂的是( )
| A. | 食盐、纯碱 | B. | KSCN、碳酸氢钠 | C. | 氨水、AgNO3 | D. | 硫酸钾、硝酸镁 |
10.某实验小组配制0.10mol/LNaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体2.0g.
(2)从如图中选择称量NaOH固体所需要的仪器是(填字母)abe.
(3)下列情况会使所配溶液浓度偏低的是(填序号)①③⑤⑦
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒.
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体2.0g.
(2)从如图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒.
14.(1)某有机物的键线式如图 ,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
(2)蒸馏含有杂质的工业乙醇,使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶.
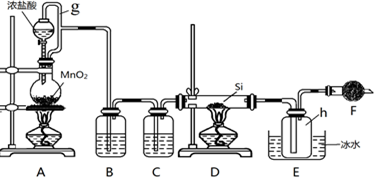
(3)为研究某有机物A的组成于结构,进行了如下实验:
(4)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题.甲醇甲醇(CH3OH)燃料电池结构如图所示,外电路中电子从A到B(填“A”或“B”)移动,写出电池负极的电极反应式CH3OH-6e-+H2O=CO2+6H+

 ,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.(2)蒸馏含有杂质的工业乙醇,使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶.
(3)为研究某有机物A的组成于结构,进行了如下实验:
| 实验步骤 | 解 释 或 实 验 结 论 |
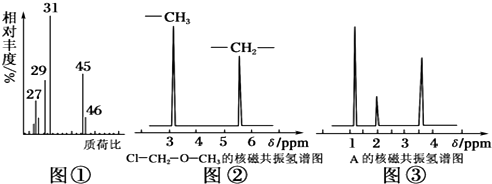
| (1)称取A 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①A的相对分子质量为90. |
(2)A的核磁共振氢谱如图: | ②A中含有4种氢原子. |

15.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| B. | 10g 46%的乙醇水溶液中所含氢原子数目为0.6NA | |
| C. | 标准状况下8.96L的平均相对分子质量为3.5的H2与D2含有中子数0.3NA | |
| D. | 1molCu与足量的S完全反应,转移电子数为2NA |
 .
.