题目内容
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③HCl ④NH3?H2O.请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的 (填序号,下同),在发生水解反应的溶液中pH最大的是 .
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的溶液中离子浓度由大到小的顺序为 .
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中
的值 (填“增大“或“减小“或“不变“)
(4)将等体积的③和④的溶液混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于“或“小于“或“等于“),此时溶液中离子浓度由大到小的顺序是 .
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.
(1)上述溶液中,可发生水解反应的
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的溶液中离子浓度由大到小的顺序为
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中
| c(NH4+) |
| c(OH-) |
(4)将等体积的③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
考点:盐类水解的原理,水的电离,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)含有弱离子的盐能发生水解,弱酸(或弱碱)越弱,水解程度越大,水解是微弱的,不如碱的碱性强;
(2)这几种物质中,能和强碱、强酸反应的物质为弱酸的酸式盐,HCO3-电离程度小于水解程度,其溶液呈碱性;
(3)向氨水中加入氯化铵抑制一水合氨电离;
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,根据溶液酸碱性结合电荷守恒判断离子浓度大小;
(5)酸对水的电离有抑制作用,据KW计算出水电离出来的氢氧根离子浓度,水电离出的氢离子和氢氧根离子浓度相等,据此求算.
(2)这几种物质中,能和强碱、强酸反应的物质为弱酸的酸式盐,HCO3-电离程度小于水解程度,其溶液呈碱性;
(3)向氨水中加入氯化铵抑制一水合氨电离;
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,根据溶液酸碱性结合电荷守恒判断离子浓度大小;
(5)酸对水的电离有抑制作用,据KW计算出水电离出来的氢氧根离子浓度,水电离出的氢离子和氢氧根离子浓度相等,据此求算.
解答:
解:(1)含有弱离子的盐能发生水解,碳酸钠和碳酸氢钠都是含有弱离子的盐,能发生水解;水解是中和反应的逆反应,程度小,不如碱的碱性强,NH3?H2O的pH增大,故答案为:①②;④;
(2)这几种物质中,能和强碱、强酸反应的物质是碳酸氢钠,HCO3-水解程度大于电离程度,但程度都较小,溶液呈碱性,溶液中HCO3-水解和水都电离生成氢氧根离子,HCO3-的电离和水的电离都能产生氢离子,氢离子浓度大于碳酸根,溶液中离子浓度大小顺序是c(Na+)>c(HCO3- )>c(OH-)>c(H+)>c(CO32- ),故答案为:c(Na+)>c(HCO3- )>c(OH-)>c(H+)>c(CO32- );
(3)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以
的值增大,故答案为:增大;
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),中性溶液中水的电离程度很小,所以离子浓度大小顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+),故答案为:小于;c(Cl-)=c(NH4+)>c(OH-)=c(H+);
(5)取10mL溶液0.5mol/L的盐酸,加水稀释到500mL,c(H+)=
=0.01mol/L,据常温下水的离子积常数可知,c(OH-)水=
=10-12,所以水电离出来的氢离子浓度为10-12,故答案为:10-12.
(2)这几种物质中,能和强碱、强酸反应的物质是碳酸氢钠,HCO3-水解程度大于电离程度,但程度都较小,溶液呈碱性,溶液中HCO3-水解和水都电离生成氢氧根离子,HCO3-的电离和水的电离都能产生氢离子,氢离子浓度大于碳酸根,溶液中离子浓度大小顺序是c(Na+)>c(HCO3- )>c(OH-)>c(H+)>c(CO32- ),故答案为:c(Na+)>c(HCO3- )>c(OH-)>c(H+)>c(CO32- );
(3)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以
| [NH4+] |
| [OH-] |
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),中性溶液中水的电离程度很小,所以离子浓度大小顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+),故答案为:小于;c(Cl-)=c(NH4+)>c(OH-)=c(H+);
(5)取10mL溶液0.5mol/L的盐酸,加水稀释到500mL,c(H+)=
| 0.5mol/L×0.01L |
| 0.5L |
| 10-14 |
| 0.01 |
点评:本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,两者快慢相同 |
| B、盛有相同浓度的双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C、将浓硝酸分别放在的冷暗处和强光,发现强光下的浓硝酸分解得快 |
| D、将相同浓度Na2S2O2溶液与硫酸溶液混合,升高温度后溶液出现浑浊的时间变短,原因是反应物分子的能量增加,单位体积内活化分子百分数增大,有效碰撞次数增 |
心酮胺是治疗冠心病的药物.它具有如下结构简式:下列关于心酮胺的描述,错误的是( )
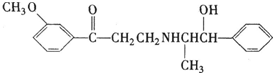
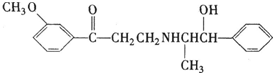
| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
下列氯化物中,不能用金属单质和氯气直接反应制得的是( )
| A、CuCl2 |
| B、FeCl2 |
| C、MgCl2 |
| D、NaCl |
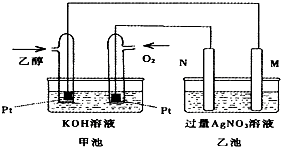 如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )
如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )| A、M电极的材料是石墨 |
| B、若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C、在此过程中,甲池中OH-向通乙醇的一极移动 |
| D、在此过程中,乙池溶液中电子从M电极向N电极移动 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、电解MgCl2溶液,可制得金属镁 |