题目内容
12.下列叙述正确的是( )| A. | 0.1mol/L的KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-) | |
| B. | 25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液中离子浓度的关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 在0.1 mol/LNH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c (HClO)] |
分析 A.根据KHC2O4溶液中的电荷守恒判断;
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)中不满足电荷守恒;
C.根据氯化铵溶液中的质子守恒判断;
D.氯水中还存在没有反应的氯气分子,该关系不成立.
解答 解:A.0.1mol/L的KHC2O4溶液中,根据电荷守恒可知:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故A正确;
B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知c(NH4+)>c(Cl-),溶液中离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.在0.1 mol/LNH4Cl溶液中,根据质子守恒可得:c(H+)=c(NH3•H2O)+c(OH-),故C正确;
D.氯水中只有部分氯气与水反应生成氯化氢和次氯酸,则溶液中c(Cl2)≠2[c(ClO-)+c(Cl-)+c (HClO)],故D错误;
故选AC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、质子守恒及盐的水解原理的含义为解答关键,D为易错点,注意氯水中还存在未反应的氯气分子.

练习册系列答案
相关题目
3.下列有关铁的叙述错误的是( )
| A. | 铁的熔点比生铁要高 | |
| B. | 不能通过化合反应制得FeC12 | |
| C. | 地壳中含量铝比铁高,但在我国使用上铁比铝历史悠久 | |
| D. | Fe3O4既可以是铁与氧气反应的产物也可以是铁与水蒸气反应的产物 |
20.室温下,有pH=3的盐酸、硫酸、醋酸(假设HAc的电离度为1%)三种相同体积的溶液.以下叙述错误的是( )
| A. | 测定其导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:1:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:2:100 |
7.复方蒿甲醚是目前国际上广泛认可的中国原创药品,它在疟疾这一高传染性疾病治疗史上具有里程碑的意义.该药品主要成分是青蒿素,结构如图.有关青蒿素的叙述中正确的是( )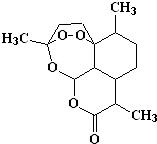

| A. | 青蒿素的化学式为C16H20O5 | |
| B. | 该有机物不能和NaOH溶液反应 | |
| C. | 青蒿素易溶于水 | |
| D. | 由于青蒿素中含有过氧键(-O-O-),具有较强的氧化性 |
17.久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的是( )
| A. | 过氧化钠固体 | B. | 苯酚晶体 | C. | 硫酸亚铁晶体 | D. | 亚硫酸钠固体 |
4.A与B在溶液中进行反应,无论A与B的物质的量之比如何,都可以用所示的离子方程式表示的是( )
| A. | 碘化钾与氯气:5I-+3Cl2-+3H2O→IO3-+6Cl-+6H+ | |
| B. | KAl(SO4)2与Ba(OH)2:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O | |
| C. | 氨水与SO2:NH3•H2O+SO2→HSO3-+NH4+ | |
| D. | NaAlO2与AlCl3:Al3++3AlO2-+6H2O→4Al (OH)3↓ |
1.下列属于碱性氧化物的是( )
| A. | CaO | B. | Na2O2 | C. | SiO2 | D. | Mn2O7 |
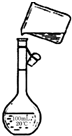 实验室欲配置500mL 0.40mol/L NaNO3溶液.
实验室欲配置500mL 0.40mol/L NaNO3溶液.