题目内容
15. 实验室欲配置500mL 0.40mol/L NaNO3溶液.
实验室欲配置500mL 0.40mol/L NaNO3溶液.(1)配置溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;g.称量.称量硝酸钠固体的质量是17.0g.按操作顺序第六步是a(写序号)
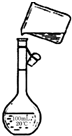
(2)茜茜同学转移溶液的操作如图,图中仪器的名称是烧杯和500mL容量瓶.该同学操作中的错误是未用玻璃棒引流.
(3)①林林同学用0.400mol/L盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取25.0mL盐酸.
②假设苗苗同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现消耗的盐酸体积小于①中所求体积,则可能的原因是c
a.浓盐酸挥发,浓度不足 b.配置溶液时,未洗涤烧杯
c.配置溶液时,俯视容量瓶刻度线 d.加水时超过刻度线,用胶头滴管吸出.
分析 (1)依据m=CVM计算需要硝酸钠的质量;依据配制一定物质的量浓度溶液一般步骤排序解答;
(2)配制一定物质的量浓度的溶液需要500mL容量瓶,向容量瓶中转移液体需要用玻璃棒引流;
(3)①根据n(HCl)=n(NaOH)计算;
②盐酸体积减少,说明标准液盐酸体积读数减小,据此分析解答.
解答 解:(1)制备500mL 0.4mol/L的NaNO3溶液,需要500mL容量瓶,则需要硝酸钠的质量为0.5L×0.4mol/L×85g/mol=17.0g,配制的步骤依次为计算、称量、溶解、转移、洗涤、定容、摇匀等操作,故第6步为定容;
故答案为:17.0;a;
(2)配制一定物质的量浓度的溶液需要500mL容量瓶,向容量瓶中转移液体需要用玻璃棒引流,
故答案为:500mL容量瓶;未用玻璃棒引流;
(3)①)①n(HCl)=n(NaOH)=0.01mol,V(HCl)=$\frac{0.01mol}{0.400mol•L{\;}^{-1}}$=0.025L=25.0mL,
故答案为:25.0;
②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,
a、浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故a不选;
b、配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故b不选;
c、配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故c选;
d、加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故d不选;
故选:c.
点评 本题考查了物质的量浓度的有关计算及配置一定物质的量浓度的溶液等知识点,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列叙述正确的是( )
| A. | 0.1mol/L的KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-) | |
| B. | 25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液中离子浓度的关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 在0.1 mol/LNH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c (HClO)] |
13.下列说法正确的是( )
| A. | 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水,可检验淀粉是否水解 | |
| B. | 做过碘升华的圆底烧瓶可以用酒精洗涤 | |
| C. | 为了验证Na2CO3固体中是否含有NaHCO3,溶于水后加石灰水,看有无沉淀 | |
| D. | 用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
3.下列物质的使用,不涉及化学变化的是( )
| A. | 氢氟酸刻蚀玻璃 | B. | 生石灰做干燥剂 | ||
| C. | 液氨做制冷剂 | D. | 氢氧化铝可作胃酸中和剂 |
10.下列关于安全事故的处理方法,正确的是( )
| A. | 金属钠着火时,立即用沾水的毛巾覆盖 | |
| B. | 不慎渗出的酒精在桌上着火时,立即用大量水扑灭 | |
| C. | 大量氯气泄漏时,迅速离开现场,并尽量往高处去 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
7.用下列装置能达到实验目的是( )
| A. |  分离酒精和乙酸 | B. |  制取少量蒸馏水 | ||
| C. |  转移溶液 | D. |  分离淀粉溶液中的水 |
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中:K+、NO3-、I-、Na+、AlO2- | |
| C. | Na2S溶液中:K+、SO42-、Cl-、Cu2+ | |
| D. | 由水电离的c(H+)=1.0×10-13 mol/L的溶液中:C6H5O-、K+、SO42-、C1- |
5.下列物质的熔点,前者大于后者的是( )
| A. | 晶体硅、碳化硅 | B. | 甲苯、苯酚 | C. | 氧化镁、氧化钠 | D. | 钾钠合金、钠 |