题目内容
下列各装置中都盛有0.1mol?L-1 的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是( )
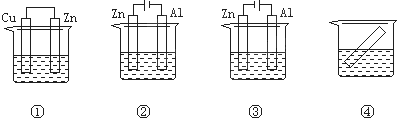

| A、③①④② | B、①②④③ |
| C、②①④③ | D、②①③④ |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:电化学腐蚀较化学腐蚀快,金属得到保护时,腐蚀较慢,作原电池正极和电解池阴极的金属被保护.
解答:
解:①中锌作负极,发生电化学腐蚀,加快锌的腐蚀,②中锌作电解池阳极,在外加电源的作用下,更加快锌的腐蚀,③中锌作电解池阴极,不易被腐蚀,④中发生化学腐蚀,所以腐蚀速率由快到慢的顺序为②①④③.
故选C.
故选C.
点评:本题考查不同条件下金属腐蚀的快慢,明确腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀即可解答.

练习册系列答案
相关题目
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
| A、AgNO3 (Ag2O) |
| B、NaOH(NaOH) |
| C、NaCl (盐酸) |
| D、CuSO4(Cu(OH)2) |
下列关于杂化轨道的叙述中,不正确的是( )
| A、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
钢铁腐蚀发生得最普遍的是( )
| A、化学腐蚀 | B、析氢腐蚀 |
| C、吸氧腐蚀 | D、摩擦 |
已知:①lmolH2分子中化学键断裂时需要吸收436kJ的能量②1mol C12分子中化学键断裂时需要吸收243kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431kJ的能量下列叙述中正确的是( )
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g)△H=366KJ?mol-1 |
| B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=366KJ?mol-1 |
| C、氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ?mol-1 |
| D、氢气和氯气反应生成1 mol氯化氢气气体,反应的△H=-183KJ?mol-1 |
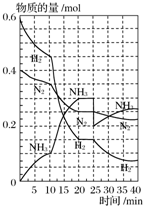 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A、从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol?L-1?min-1 |
| B、平衡在10 min至20 min的变化,可能是因为增大了容器体积 |
| C、25 min时,分离出了0.1 mol NH3 |
| D、在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.