题目内容
下列关于杂化轨道的叙述中,不正确的是( )
| A、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
考点:原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子;
B、价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
C、杂化前后的轨道数不变,空间伸展方向发生变化;
D、根据其空间构型判断夹角.
B、价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
C、杂化前后的轨道数不变,空间伸展方向发生变化;
D、根据其空间构型判断夹角.
解答:
解:A、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键,故A错误;
B、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,中心原子采取sp3杂化的分子,其立体构形不一定是正四面体,如水分子中价层电子对个数=2+
×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,故B正确;
C、杂化前后的轨道数不变,轨道的形状发生了改变,杂化后,各个轨道尽可能分散、对称分布,故C正确;
D、sp3、sp2、sp杂化轨道其空间构型分别是正四面体、平面三角形、直线型,所以其夹角分别为109°28′、120°、180°,故D正确.
故选:A.
B、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,中心原子采取sp3杂化的分子,其立体构形不一定是正四面体,如水分子中价层电子对个数=2+
| 1 |
| 2 |
C、杂化前后的轨道数不变,轨道的形状发生了改变,杂化后,各个轨道尽可能分散、对称分布,故C正确;
D、sp3、sp2、sp杂化轨道其空间构型分别是正四面体、平面三角形、直线型,所以其夹角分别为109°28′、120°、180°,故D正确.
故选:A.
点评:本题考查杂化轨道和杂化理解,侧重分子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
下列物质中,不可用来漂白、杀菌消毒的是( )
| A、次氯酸钠 | B、过氧化钠 |
| C、氯水 | D、含碘食盐 |
加水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A、
| ||
B、
| ||
| C、c(H+)?c(OH-) | ||
| D、n(OH-) |
下列说法不正确的是( )
| A、浓硫酸能与铜反应释放出氢气 |
| B、浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫 |
| C、浓硫酸具有吸水性,在实验中常用作干燥剂 |
| D、冷的浓硫酸可以用铁质或铝质容器储存 |
下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是( )
| A、HCl、CaCO3、SO2 |
| B、KNO3、CH3COOH、NH3 |
| C、HClO、H2S、C2H5OH |
| D、BaSO4、H3PO4、H2O |
下列各装置中都盛有0.1mol?L-1 的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是( )
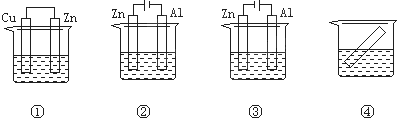

| A、③①④② | B、①②④③ |
| C、②①④③ | D、②①③④ |
改变下列某一条件:①浓度 ②压强 ③温度 ④催化剂,其中一定能使化学平衡发生移动的是( )
| A、①④ | B、②③ | C、①③ | D、②④ |
下列说法正确的是( )
| A、1mol氧气中含有1.204×1024个氧原子,通常情况下占有体积约为22.4L |
| B、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| D、欲配制1.00L1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |