题目内容
4.有8个试剂瓶,分别盛有下面8种溶液:①硫酸铜溶液,②小苏打溶液,③碘酒溶液,④稀硝酸溶液,⑤醋酸溶液,⑥乙醛溶液,⑦烧碱溶液,⑧75%乙醇溶液.回答下面问题(1)请根据一定的分类标准,从中任意选出三种.它们的溶质的化学式是③、⑤、⑥,将它们归为一类的依据是属于有机物.
(2)乙醛分子中含有的官能团名称是醛基,乙醇分子核磁共振氢谱有3个波峰.
(3)写出乙醇与乙酸反应生成的有机物CH3COOCH2CH3(填结构简式),该反应类型是取代(酯化).
分析 (1)涉及物质有无机物和有机物,无机物有酸、碱和盐;
(2)乙醛含有醛基,乙醇有3种H;
(3)乙酸和乙醇发生酯化反应生成乙酸乙酯.
解答 解:(1)题中①②④⑦属于无机物,其中①②属于盐溶液,④属于酸溶液,⑦属于碱溶液,③⑤⑥⑧属于有机物的水溶液,
故答案为:③⑤⑥;属于有机物;
(2)乙醛含有醛基,乙醇有3种H,乙醇分子核磁共振氢谱有3个波峰,故答案为:醛基;3;
(3)乙酸和乙醇发生酯化反应生成乙酸乙酯,结构简式为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;取代(酯化).
点评 本题考查较为综合,涉及物质的分类以及有机物的性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的官能团的性质,难度不大.

练习册系列答案
相关题目
16.下列7种物质内部存在正四面体结构的最大组合是( )
①白磷 ②甲烷 ③四氯化碳 ④金刚石 ⑤二氧化硅 ⑥铵根 ⑦氯仿.
①白磷 ②甲烷 ③四氯化碳 ④金刚石 ⑤二氧化硅 ⑥铵根 ⑦氯仿.
| A. | ①②④⑦ | B. | ①②③④ | C. | ①②③⑥ | D. | ①②③④⑤⑥ |
17.某羧酸酯的分子式C8H16O2,1mol该酯完全水解可得到1mol乙醇和1mol羧酸A,羧酸A的分子式为( )
| A. | C4H8O2 | B. | C5H10O2 | C. | C6H12O2 | D. | C7H14O2 |
12.将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s)?2C(g),忽略固体体积,平衡时C的体积分数(%)随温度和压强的变化如下表所示:
①a<b;
②该反应的熵变△S<0;
③900℃、2.0MPa时E的转化率为60%;
④K(1000℃)>K(800℃);
⑤正反应为吸热反应.
上述①~⑤中正确的有( )
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
②该反应的熵变△S<0;
③900℃、2.0MPa时E的转化率为60%;
④K(1000℃)>K(800℃);
⑤正反应为吸热反应.
上述①~⑤中正确的有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
9. 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
②近似认为0.50mol/L KOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容为c=4.18J/(g•℃),则中和热△H=-53.50 kJ•mol-1.
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
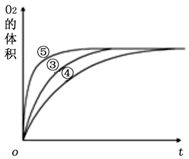
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
16.将标准状况下6.72L的CO2通入含14.8g Ca(OH)2的石灰水中,所得沉淀的质量是( )
| A. | 1 g | B. | 10 g | C. | 20 g | D. | 30 g |
14.对于反应N2+3H2?2NH3,欲使正反应速率增大,可采取( )
| A. | 减小NH3的浓度 | B. | 降低反应体系的温度 | ||
| C. | 降低压强 | D. | 缩小容器体积 |