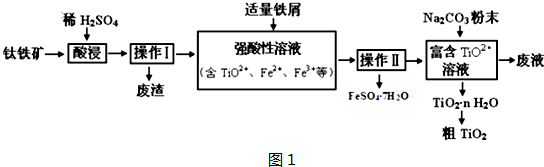
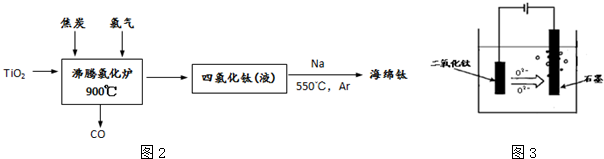
题目内容
6.下列说法或表示方法正确的是( )| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
分析 A.先计算H2O和D2O的物质的量,再计算分子中质子数;
B.${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl是氯原子,核外电子数相同,最外层电子数相同,得到电子能力相同;
C.同位素是质子数相同的不同原子;
D.原子符号是质量数标注在左上角,质子数在左下角.
解答 解:A.质量相同的H2O和D2O的物质的量为:$\frac{18g}{18g/mol}$,$\frac{18g}{20g/mol}$,所以质子数$\frac{18g}{18g/mol}$×10,$\frac{18g}{20g/mol}$×10,质子数不同,故A错误;
B.${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl是氯原子,核外电子数相同,最外层电子数相同,得到电子能力相同,故B正确;
C.同位素是质子数相同的不同原子,第IA族元素铯的两种同位素137Cs比133Cs质子数相同,故C错误;
D.原子符号是质量数标注在左上角,质子数在左下角,中子数为146、质子数为92的铀(U)原子,质量数=146+92=238,原子符号23892U,故D错误;
故选B.
点评 本题考查了原子结构、微粒数计算分析,掌握微粒之间的计算方法和表示方法是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列化学用语书写正确的是( )
| A. | 1个氖原子 Na | B. | +2价的铁元素 Fe+2 | ||
| C. | 4个氢分子 4H | D. | 3个硝酸根离子 3NO3- |
17.苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10-5、K1=4.3×10-7,下列说法正确的是(不考虑饮料中其他成分)( )
| A. | 提高CO2充气压力,饮料中c(A-)不变 | |
| B. | 当pH为5.0时,饮料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| D. | 结合H+的能力:A->HCO3- |
1.元素的性质包含金属性和非金属性,其强弱可以通过该元素对应的某些化学性质体现出来.某同学认为铝元素是金属元素,但是有一定的非金属性.下列化学反应中,你认为能证明铝有非金属性的是( )
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
18.在1mol/L CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液pH下降,可采取( )
①加NaOH(s)②加水③加CH3COOH④加CH3COONa(s)⑤加CaCO3(s)⑥加HCl(g)
①加NaOH(s)②加水③加CH3COOH④加CH3COONa(s)⑤加CaCO3(s)⑥加HCl(g)
| A. | ①④ | B. | ③⑥ | C. | 只有② | D. | 只有⑤ |
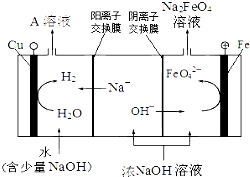
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐在低温碱性环境中稳定,易溶于水,难溶于无水乙醇等有机溶剂.
常见高铁酸钾的制备方法如下:
(1)干法制备反应中氧化剂和还原剂的物质的量之比为:3:1.
(2)某湿法制备高铁酸钾的基本流程及步骤如下:
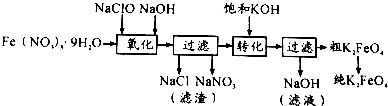
①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是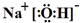 .
.
常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:

①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
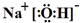 .
.
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.