题目内容
12.下列解释事实的化学方程式不正确的是( )| A. | 将氯气与通入冷的消石灰中反应制漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| B. | 向较浓的Na2SiO3溶液中滴加适量盐酸制得硅酸胶体:Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 用氢氟酸刻蚀玻璃:SiO2+4HF═SiF4+2H2O |
分析 A、氯气与消石灰反应生成CaCl2、Ca(ClO)2、H2O;
B、硅酸钠与氯化氢反应生成硅酸胶体和氯化钠;
C、铁在潮湿的环境中发生的是吸氧腐蚀;
D、氢氟酸与二氧化硅反应.
解答 解:A、氯气与消石灰反应生成CaCl2、Ca(ClO)2、H2O,其反应的方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,故A正确;
B、向较浓的Na2SiO3溶液中滴加盐酸制得硅酸胶体,反应的化学方程式为Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl,故B正确;
C、铁在潮湿的环境中发生的是吸氧腐蚀,方程式为:2Fe+3O2=Fe2O3,故C错误;
D、氢氟酸与二氧化硅反应,可用于雕刻玻璃,方程式为:SiO2+4HF═SiF4+2H2O,故D正确;
故选C.
点评 本题综合元素化合物的考查,为高考高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.请写出除去下列杂质的化学方程式.
| 物质 | 杂质 | 化学方程式 | |
| ① | Na2CO3溶液 | NaHCO3 | NaOH+NaHCO3=H2O+Na2CO3 |
| ② | Mg粉 | Al 粉 | 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ |
| ③ | CO2 | SO2 | SO2+2NaHCO3═Na2SO3+H2O+2CO2 |
3.一澄清透明的溶液中,已知各离子的浓度相等,可能含有的阳离子有Na+、Fe2+、Ba2+、NH4+,可能含有的阴离子有Cl-、NO3-、CO32-、SO42-.向该混合溶液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变.下列叙述正确的是( )
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
7.为检验某溶液中的离子,下列操作方法及结论正确的是( )
| A. | 加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ | |
| B. | 加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| C. | 加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- | |
| D. | 加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
4.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②生成物产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂.
①生成物的质量分数一定增加 ②生成物产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂.
| A. | ②⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ④⑥ |
2.用 NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 22.4LCO2与足量的 Na2O2反应时,转移的电子数为 NA 个 | |
| B. | 0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA 个 | |
| C. | 对于反应:A(g)+B(g)?C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 | |
| D. | Zn-H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g |
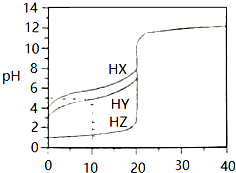 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题: