题目内容
11.现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作: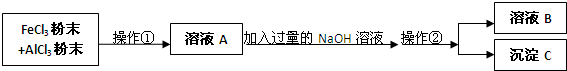
(1)操作①名称是溶解,操作②名称是过滤(过滤/萃取/分液/蒸馏/溶解/结晶);
(2)溶液B是NaAlO2,沉淀C是Fe(OH)3(AlCl3/FeCl3/Al(OH)3/Fe(OH)3/NaAlO2);
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈血红色;
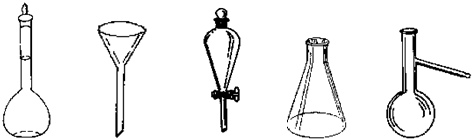
(4)下图所示仪器中,操作②需要用到的仪器是漏斗(填仪器的名称);
(5)请写出在溶液中,FeCl3和NaOH反应的化学方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
分析 AlCl3和FeCl3的混合粉末加入水溶解,在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,以此解答该题.
解答 解:AlCl3和FeCl3的混合粉末加入水溶解,在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,
(1)由以上分析可知操作①为溶解,操作②为过滤,故答案为:溶解、过滤;
(2)在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,故答案为:NaAlO2;Fe(OH)3;
(3)Fe3+可与KSCN发生反应生成血红色溶液,故答案为:血红;
(4)操作②为过滤,用到的仪器有漏斗等,故答案为:漏斗;
(5)FeCl3和NaOH反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
点评 本题考查物质的分离、提纯,为高频考点和常见题型,题目综合考查元素化合物知识的理解和运用,着重于化学实验基本方法的训练和培养,难度不大.

练习册系列答案
相关题目
1.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收1mol SO2就会放出5.6LCO2 |
2.请写出除去下列杂质的化学方程式.
| 物质 | 杂质 | 化学方程式 | |
| ① | Na2CO3溶液 | NaHCO3 | NaOH+NaHCO3=H2O+Na2CO3 |
| ② | Mg粉 | Al 粉 | 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ |
| ③ | CO2 | SO2 | SO2+2NaHCO3═Na2SO3+H2O+2CO2 |
6.下列离子方程式中正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:Fe2++Cl2═Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
16.已知苹果酸的结构简式为: 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 苹果酸分子中存在5种不同种类的氢原子 | |
| B. | 1mol苹果酸可与3mol NaOH完全中和 | |
| C. | 苹果酸与 互为同分异构体 互为同分异构体 | |
| D. | 苹果酸分子中的所有碳原子可能处在同一条直线上 |
3.一澄清透明的溶液中,已知各离子的浓度相等,可能含有的阳离子有Na+、Fe2+、Ba2+、NH4+,可能含有的阴离子有Cl-、NO3-、CO32-、SO42-.向该混合溶液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变.下列叙述正确的是( )
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |

 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题: