题目内容
16.只用一种试剂就能鉴别BaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液,此试剂是( )| A. | HCl | B. | NaOH | C. | Ba(OH)2 | D. | Na2CO3 |
分析 检验铵根离子选择碱,检验硫酸根离子选择钡离子,则选择氢氧化钡可鉴别,以此来解答.
解答 解:A.均与盐酸不反应,不能鉴别,故A不选;
B.NaOH不能鉴别NH4Cl、(NH4)2SO4,Na2SO4、BaCl2均与NaOH不反应,故B不选;
C.BaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液分别与Ba(OH)2反应的现象为:无现象、刺激性气体、白色沉淀、白色沉淀和刺激性气体,现象不同,可鉴别,故C正确;
D.均与碳酸钠不反应,不能鉴别,故D错误;
故选C.
点评 本题考查物质的检验及鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质及发生的反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.高温下,Fe与水蒸气反应生成Fe3O4和H2.下列有关该反应的说法正确的是( )
| A. | H2O是还原剂 | B. | Fe被氧化 | C. | H2O发生氧化反应 | D. | Fe得到电子 |
7.25℃时下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH<7:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| B. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH) | |
| C. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
4.下列装置或操作能达到实验目的是( )


| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①②③④ |
1.下列说法中正确的是(设NA表示阿伏加德罗常数)( )
| A. | NA个氮气分子与NA个一氧化碳分子所含的电子数相等 | |
| B. | 在标准状况下,1摩尔铜恰好与400ml 10mol/L的浓硝酸反应,可收集到22.4L的气体 | |
| C. | 2mol•L-1 氨水溶液中含有2NA个NH4+ | |
| D. | 1mol氨气溶于1升水中,所得溶液的浓度为1mol/L |
8.X、Y、Z三种气体都能污染大气,由于它们都能与碱反应,因此,在工业上常用碱液来吸收它们.其中,X是活泼非金属元素的单质,工业上制造漂白粉时要用到它;Y是煤燃烧的产物之一,是形成酸雨的主要物质;Z为汽车尾气中的有害物质之一,是一种红棕色气体.
(1)写出这三种气体的化学式:XCl2、YSO2、ZNO2.
(2)分别写出他们与水反应的化学方程式,指出这些反应中哪些是氧化还原反应.
(1)写出这三种气体的化学式:XCl2、YSO2、ZNO2.
(2)分别写出他们与水反应的化学方程式,指出这些反应中哪些是氧化还原反应.
| 气体和水反应的化学方程式 | 是否氧化还原反应 (填“是”或“否”) | |
| X+H2O | ||
| Y+H2O | ||
| Z+H2O |
5.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )
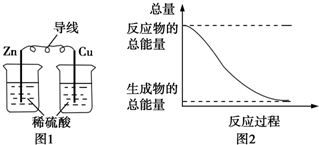

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
6.一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)?Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度为原来的1/2 | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |