题目内容
1.下列说法中正确的是(设NA表示阿伏加德罗常数)( )| A. | NA个氮气分子与NA个一氧化碳分子所含的电子数相等 | |
| B. | 在标准状况下,1摩尔铜恰好与400ml 10mol/L的浓硝酸反应,可收集到22.4L的气体 | |
| C. | 2mol•L-1 氨水溶液中含有2NA个NH4+ | |
| D. | 1mol氨气溶于1升水中,所得溶液的浓度为1mol/L |
分析 A、氮气和CO中均含14个电子;
B、铜和浓硝酸反应,随着浓硝酸浓度的变稀,还原产物为NO2、NO、N2O、N2,甚至为NH4+;
C、一水合氨为弱电解质,不能完全电离;
D、氨气和水的反应为可逆反应,不能完全进行.
解答 A、氮气和CO中均含14个电子,故NA个氮气分子与NA个一氧化碳分子所含的电子数相等,且均为14NA个,故A正确;
B、铜和浓硝酸反应,随着浓硝酸浓度的变稀,还原产物为NO2、NO、N2O、N2,甚至为NH4+,故1mol铜和4mol浓硝酸恰好完全反应后,被还原的硝酸为2mol,但生成的气体的体积小于44.8L,具体的数值无法计算,故B错误;
C、一水合氨为弱电解质,不能完全电离,故溶液中的铵根离子个数小于2NA个,故C错误;
D、氨气和水的反应为可逆反应,不能完全进行,故所得溶液的浓度小于1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数2倍的位置,Z最外层电子数是其核外电子数的3/4,W与Z属于同一主族.下列叙述正确的是( )
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)<r(Y)<r(W) | |
| C. | W的简单氢化物的热稳定性比Z的强 | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
9.某气态的烷烃与烯烃的混合气体,其密度为同状况下H2密度的11倍,1体积混合气完全燃烧生成的水蒸汽体积为2体积(在同条件下),则原混合气体的组成为( )
| A. | 甲烷,丙烯 | B. | 乙烷,乙烯 | C. | 甲烷,乙烯 | D. | 乙烷,丙烯 |
16.只用一种试剂就能鉴别BaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液,此试剂是( )
| A. | HCl | B. | NaOH | C. | Ba(OH)2 | D. | Na2CO3 |
6.将1mol氨气和2mol氧气混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是( )
| A. | 二氧化氮与氧气 | B. | 一氧化氮与二氧化氮 | ||
| C. | 硝酸与一氧化氮 | D. | 硝酸与水 |
13.某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种.向该溶液加入溴水后,溴被还原,由此推断该溶液中( )
| A. | 不含NO3-,也不含Fe3+ | B. | 含有NO3-、I-、Cl- | ||
| C. | 含I-,不含Cl- | D. | 含有Fe3+ |
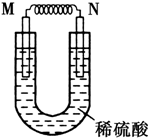 由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.
由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗. 铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题: