题目内容
10.下列实验操作中错误的是( )| A. | 向碘水中加入适量酒精,可以将碘单质萃取出来 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
分析 A.酒精和水互溶;
B.根据蒸馏时,温度计测量的成分判断温度计的位置;
C.根据分液的操作目的判断;
D.当蒸发皿中出现较多量的固体时即停止加热.
解答 解:A.酒精和水互溶,不能做萃取剂,故A错误;
B.蒸馏时,温度计测量的是馏分的温度,所以温度计水银球应靠近蒸馏烧瓶支管口,故B正确;
C.分液时,为不产生杂质,分液漏斗下层液体从下口放出,上层液体从上口倒出,故C正确;
D.蒸发结晶时应,当蒸发皿中出现较多量的固体时即停止加热,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及分液、蒸馏、蒸发结晶等实验操作,难度不大,实验是每年的必考题,要注重实验的学习、掌握.

练习册系列答案
相关题目
10.某有机物的分子式为C9H12,其属于芳香烃的同分异构体有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
18.下列反应中,属于吸热反应的是( )
| A. | 乙醇燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 氧化钙溶于水 | D. | 盐酸和氢氧化钠反应 |
15.下列有关实验原理、现象、结论等均正确的是( )
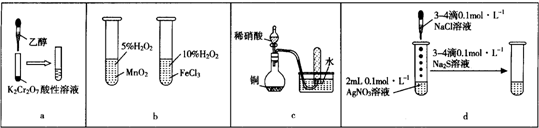

| A. | a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸 | |
| B. | b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO | |
| D. | d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S |
19.在某无色透明溶液中,能大量共存的离子组是( )
| A. | Fe3+、K+、SO42- | B. | Cu2+、SO42-、NO3- | C. | Na+、K+、Cl- | D. | MnO4-、K+、SO42- |
 硝基还原为氨基:
硝基还原为氨基: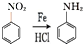
 .
.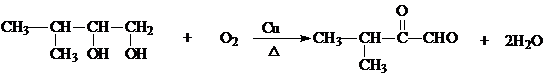 .
. .
.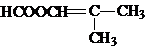 .
.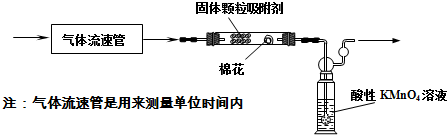
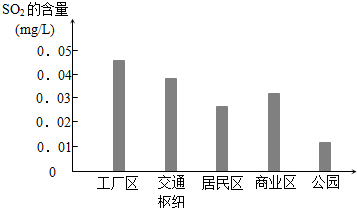
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.