题目内容
14.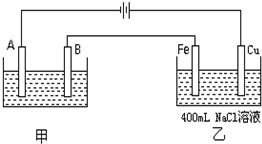 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答:(1)若甲池利用电解原理在铁上镀银,则A是铁(填电极材料名称),应选用的电解质溶液是AgNO3.
(2)乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红色,.
(3)若甲池阴极增重43.2g且乙池中阴极上一直都有气体产生,则乙池中阴极上放出的气体在标准状况下的体积是4480mL.
分析 (1)由图可知,A与电源负极相连,则A为阴极,甲池利用电解原理在铁上镀银,则铁应作阴极,银作阳极,电解液中含有银离子,以此来分析;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极(铁)得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大;
(3)利用电子守恒可知2Ag~2e-~H2↑,以此来计算氢气的物质的量,再计算气体在标准状况下的体积.
解答 解:(1)由图可知,A与电源负极相连,则A为阴极,在铁上镀银,则铁作阴极,电极反应为Ag++e-=Ag,
银作阳极,电极反应为Ag-e-=Ag+,且电解液中含有银离子,可选AgNO3作电解液,
故答案为:铁;AgNO3;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极(铁)得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大,遇酚酞变红,则Fe电极附近变红;
故答案为:红;
(3)甲池阴极发生Ag++e-=Ag,乙池中阴极2H++e-=H2↑,
Ag的物质的量为$\frac{43.2g}{108g/mol}$=0.4mol,
由电子守恒可知,2Ag~2e-~H2↑,氢气的物质的量为0.2mol,
在标准状况下的体积为0.2mol×22.4L/mol=4.48L=4480mL,
故答案为:4480.
点评 本题考查电解原理及利用电子守恒的计算,明确阴阳极的判断及发生的电极反应是解答本题的关键,难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
4.下列微粒半径之比大于1的是( )
| A. | $\frac{r({K}^{+})}{r(K)}$ | B. | $\frac{r(Mg)}{r(Ca)}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r({S}^{2-})}{r({K}^{+})}$ |
2.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75 NA | |
| B. | 7.8 g Na2O2与足量的CO2反应时失去的电子数为0.2 NA | |
| C. | 1L 1mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16g O3所含的原子数为NA |
9.下列物质能跟镁反应并生成氢气的是( )
| A. | 氨水 | B. | 氢氧化钠溶液 | C. | 氯化铵溶液 | D. | 碳酸钠溶液 |
19.下列反应中必须加入还原剂才能进行的是( )
| A. | Mn2+→MnO${\;}_{4}^{-}$ | B. | NO${\;}_{3}^{-}$→NO | C. | H2→H2O | D. | Zn→Zn2+ |
6.光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是( )
| A. | CaO | B. | SiO2 | C. | CaCO3 | D. | Na2CO3 |
 (1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.
(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.