题目内容
若50滴水正好是mmL,则1滴水所含的分子数是( )
| A、m×50×18×6.02×1023 | ||
B、
| ||
C、
| ||
D、
|
考点:物质的量的相关计算
专题:
分析:根据m=ρV计算水的质量,根据n=
计算水的物质的量,进而计算1滴水的物质的量,根据N=nNA计算1滴水含有分子数目.
| m |
| M |
解答:
解:m mL水的质量为m ML×1g/mL=m g,其物质的量为
=
mol,1滴水的物质的量为
mol×
,1滴水含有水分子数目为
mol×
×6.02×1023mol-1=
×6.02×1023,故选B.
| mg |
| 18g/mol |
| m |
| 18 |
| m |
| 18 |
| 1 |
| 50 |
| m |
| 18 |
| 1 |
| 50 |
| m |
| 50×18 |
点评:本题考查物质的量有关计算,侧重微粒数目的计算,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
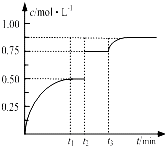 一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )| A、反应方程式中的x=1 |
| B、t2时刻改变的条件是使用催化剂 |
| C、t3时刻改变的条件是移去少量物质Q |
| D、t1~t3间该反应的平衡常数均为4 |
下列物质中,只含有离子键的是( )
| A、H2O |
| B、CO2 |
| C、MgCl2 |
| D、KOH |
CO2+NH3+H20+A═NaHCO3↓+NH4Cl是侯氏制碱法的重要反应,反应中物质A的化学式为( )
| A、Na2O |
| B、NaCl |
| C、NaOH |
| D、Na2CO3 |
下列叙述正确的是( )
| A、1 mol H2O的质量为18 g/mol |
| B、CH4的摩尔质量为16 g |
| C、3.01×1023个SO2分子的质量为32 g |
| D、2mol NaOH溶于1 L水中配成溶液的浓度为2 mol?L-1 |
设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |