题目内容
7.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是( )| A. | 能用适当的酸碱指示剂来判断 | |
| B. | 参加反应的酸中的H+离子总量和碱中OH-离子总量相等 | |
| C. | 反应混合液的pH=7 | |
| D. | 反应的热效应即为中和热 |
分析 A.无法用指示剂判断酸碱恰好反应,指示剂只能粗略判断滴定终点.
B.酸碱恰好反应时,酸中氢离子与碱溶液中的氢氧根离子的物质的量一定相等;
C.酸碱恰好反应时,溶液的pH不一定为7,如氢氧化钠与醋酸反应生成醋酸钠,醋酸钠溶液呈碱性.
D.在稀溶液中,酸跟碱发生中和反应则生成1molH2O,这时的反应热叫做中和热.
解答 解:A.指示剂只能粗略判断滴定终点,无法用指示剂判断酸碱溶液恰好反应,故A错误;
B.在室温下进行中和滴定,酸和碱恰好完全反应时,参加反应的酸中的H+离子总量和碱中OH-离子总量相等,故B正确;
C.室温下酸和碱恰好完全反应时,溶液的pH不一定等于7,如醋酸与NaOH溶液的反应,恰好反应时生成醋酸钠,醋酸根离子部分水解,溶液呈碱性,故C错误;
D.在稀溶液中,酸跟碱发生中和反应则生成1molH2O,这时的反应热叫做中和热,所以酸和碱恰好完全反应时,反应的热效应不一定为中和热,故D错误;
故选B.
点评 本题考查了中和滴定的操作方法,题目难度不大,明确酸碱恰好中和反应的含义为解答关键,注意熟练掌握中和滴定操作方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
12.在容量瓶上没有标出的标示是( )
| A. | 温度 | B. | 刻度线 | C. | 容积 | D. | 物质的量浓度 |
13.利用如图所示的装置进行实验,若装置Ⅰ中反应物充足,则装置Ⅱ中实验现象正确的是( )
| 选项 | ① | ② | ③ | Ⅱ中的现象 | 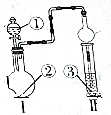 |
| A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色最终变为浅红色 | |
| B | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先产生白色沉淀,后沉淀溶解 | |
| C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
| D | 浓硝酸 | 铜 | 硅酸钠溶液 | 有胶状物生成 |
| A. | A | B. | B | C. | C | D. | D |
2.用碳酸钠晶体(Na2CO3•10H2O)配制碳酸钠溶液时,会造成所配溶液浓度偏低的是( )
| A. | 称量碳酸钠晶体(Na2CO3•10H2O)的时间太长,而且暴露在空气中 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时仰视刻度线 | |
| D. | 溶解后未冷却到室温,立即转移到容量瓶中 |
12.某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(1)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250mL 溶液,
(2)用 0.2000mol•L-1 标准盐酸滴定待测烧碱溶液,实验操作如下 A.用碱式滴定管取上述烧碱溶液10.00mL,注入锥形瓶中,加入指示剂.B.用待测定 的溶液润洗碱式滴定管.C.用蒸馏水洗干净滴定管.D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.E.检查滴定管是否漏水.F.另取锥形瓶,再重复 操作一次.G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度.
①滴定操作的正确顺序是(用序号填写):E→C→D→B→A→G→F.
②该滴定操作中应选用的指示剂是:酚酞或甲基橙.
③在G操作中如何确定终点?溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由粉红色变成无色,且半分钟内不变色,则到达滴定终点.
(3)数据处理
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为0.4500mol•L-1,烧碱 的纯度为90.0%.
(4)下列操作,会导致实验结果偏低的是①③⑤(填序号).
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗.
(1)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250mL 溶液,
(2)用 0.2000mol•L-1 标准盐酸滴定待测烧碱溶液,实验操作如下 A.用碱式滴定管取上述烧碱溶液10.00mL,注入锥形瓶中,加入指示剂.B.用待测定 的溶液润洗碱式滴定管.C.用蒸馏水洗干净滴定管.D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.E.检查滴定管是否漏水.F.另取锥形瓶,再重复 操作一次.G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度.
①滴定操作的正确顺序是(用序号填写):E→C→D→B→A→G→F.
②该滴定操作中应选用的指示剂是:酚酞或甲基橙.
③在G操作中如何确定终点?溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由粉红色变成无色,且半分钟内不变色,则到达滴定终点.
(3)数据处理
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
| 1 | 22.4 | 10.00 |
| 2 | 22.60 | 10.00 |
| 3 | 26.00 | 10.00 |
| 4 | 22.50 | 10.00 |
(4)下列操作,会导致实验结果偏低的是①③⑤(填序号).
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗.
16.室温下,下列各项中的比值为2:1的是( )
| A. | 0.2 mol•L-1醋酸溶液与 0.1 mol•L-1醋酸溶液中c(H+)之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)和c(SO42-)的物质的量浓度之比 | |
| C. | pH=2的盐酸和pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 | |
| D. | 0.2 mol/LCH3COONa溶液与 0.1 mol•L-1Na2CO3溶液中c(CH3COO-)与c(CO32-)之比 |
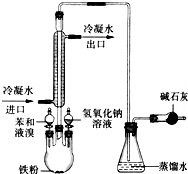 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.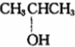 ⑨${\;}_{6}^{13}$C
⑨${\;}_{6}^{13}$C 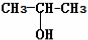 .
.