题目内容
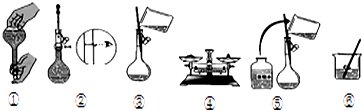
15.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸.实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④检漏、转移、洗涤 ⑤定容、摇匀
若实验仪器有:
A.100mL量筒 B.玻璃棒 C.50mL容量瓶 D.100mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯
回答下列问题:
(1)需量取浓硫酸的体积为5.4mL.
(2)实验时不需选用的仪器有(填序号)AC,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)①⑤.
①定容时俯视刻度线观察液面 ②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④所用的浓硫酸长时间放置在密封不好的容器中
⑤用量筒量取浓硫酸时仰视读数
(4)检验试剂瓶中的溶液含有SO42- 的操作是取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-.
分析 (1)先计算出浓硫酸的物质的量浓度,然后根据c1V1=c2V2计算出需要浓硫酸的体积;
(2)根据配制一定物质的量浓度的步骤选用仪器;
(3)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(4)检验硫酸根离子时,需要加入盐酸排除银离子的干扰,然后再加入氯化钡溶液,据此进行解答.
解答 解:(1)98%的浓硫酸(其密度为1.84g/cm3)的物质的量浓度为:$\frac{1000ρw}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制100mL 1.0mol•L-1稀硫酸,需要该浓硫酸的体积为:$\frac{1.0mol/L×0.1L}{18.4mol/L}$≈0.0054L=5.4mL,
故答案为:5.4;
(2)根据配制100mL 1.0mol•L-1稀硫酸的步骤可知,配制过程中需要的仪器为:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,所以需要使用的仪器为:AC,
故答案为:AC;
(3)①定容时俯视刻度线观察液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,故①正确,
②容量瓶使用时未干燥,对溶质的物质的量及溶液的最终体积没有影响,不影响配制结果,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故③错误;
④.所用的浓硫酸长时间放置在密封不好的容器中,导致浓硫酸浓度减小,量取的浓硫酸中含有的硫酸的物质的量偏小,配制的溶液浓度偏低,故④错误;
⑤用量筒量取浓硫酸时仰视读数,导致量取的浓硫酸体积偏大,配制的溶液中溶质的物质的量偏大,溶液的浓度偏高,故⑤正确;
故答案为:①⑤;
(4)检验硫酸根离子时,需要使用氯化钡溶液,所以应该先加入盐酸,排除氯化银的干扰,正确的检验方法为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-,
故答案为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-.
点评 本题考查了配制一定物质的量浓度的溶液的方法、氧化还原反应的计算、硫酸根离子检验等知识,试题题量较大,知识点较多,该题是中等难度的试题,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

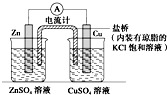
| A. | 该装置中电子由Zn极流向Cu极,CuSO4溶液中的SO41-通过盐桥移向Zn极 | |
| B. | 若装置中的两烧杯中均为CuSO4溶液,则电流计的指针偏转幅度变小,且很快减弱 | |
| C. | 将装置中烧杯内的溶液对换,电流计的指针也能发生偏转 | |
| D. | 将盐桥改为铜导线连接两种溶液,电流方向为由Cu极到Zn极 |
| A. | 用水鉴别乙醇和乙酸 | |
| B. | 将甲烷通入氯水中生成一氯甲烷 | |
| C. | 在苯中滴入稀硝酸制硝基苯 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
| A. | 能用适当的酸碱指示剂来判断 | |
| B. | 参加反应的酸中的H+离子总量和碱中OH-离子总量相等 | |
| C. | 反应混合液的pH=7 | |
| D. | 反应的热效应即为中和热 |
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |