题目内容
2.用碳酸钠晶体(Na2CO3•10H2O)配制碳酸钠溶液时,会造成所配溶液浓度偏低的是( )| A. | 称量碳酸钠晶体(Na2CO3•10H2O)的时间太长,而且暴露在空气中 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时仰视刻度线 | |
| D. | 溶解后未冷却到室温,立即转移到容量瓶中 |
分析 根据物质的量浓度c=$\frac{n}{V}$分析不当操作对n或V的影响,如果n偏小或V偏大,则所配制溶液浓度偏低,据此进行分析.
解答 解:A.称量碳酸钠晶体(Na2CO3•10H2O)的时间太长,且暴露在空气中,会造成结晶水的挥发,则所称量的晶体中Na2CO3的含量升高,则所配溶液的浓度偏高,故A错误;
B.因定容时需向容量瓶中加水,所以定容前容量瓶中原有少量蒸馏水,对溶液的体积不变,浓度无影响,故B错误;
C.定容时仰视刻度线,会导致溶液体积偏大,则浓度偏低,故C正确;
D.溶解后未经冷却立即转移到容量瓶中并定容,液体存在热胀冷缩,冷却至室温时体积变小,溶质不变,溶液浓度偏高,故D错误;
故选C.
点评 本题考查了溶液配制的中误差分析,题目难度不大,明确正确的配制操作方法为解答关键,注意掌握误差分析的方法与技巧,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
8.下列物质中,不属于卤代烃的是( )
| A. | 氯乙烯 | B. | 溴苯 | C. | 四氯乙烯 | D. | 二氧化硅 |
7.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是( )
| A. | 能用适当的酸碱指示剂来判断 | |
| B. | 参加反应的酸中的H+离子总量和碱中OH-离子总量相等 | |
| C. | 反应混合液的pH=7 | |
| D. | 反应的热效应即为中和热 |
11.设NA为阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 1mol Na2O2和Na2O中离子总数均为2NA | |
| C. | 1mol Mg与足量O2或N2反应均失去2NA个电子 | |
| D. | 标准状况下22.4L H2含有NA个分子 |
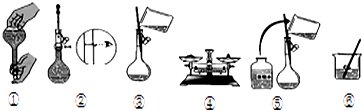
 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
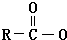 Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3
Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为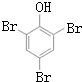 .
.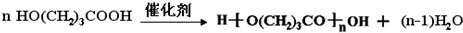 ;
;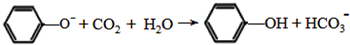 .
. (写结构简式).
(写结构简式).